题目内容
(1)25℃时,在pH=12的某溶液中,由水电离的c(OH-)可能为 .
(2)25℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va>Vb 和b=2a.则b的取值范围是 .
(2)25℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va>Vb 和b=2a.则b的取值范围是
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)室温下,在pH=12的溶液呈碱性,该溶液中的溶质可能是碱或强碱弱酸盐,碱抑制水电离,含有弱根离子的盐促进水电离,根据溶质的性质分析解答;
(2)体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,则:Va?10-a=Vb?10b-14,结合Va>Vb和a=0.5b进行计算和判断.
(2)体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,则:Va?10-a=Vb?10b-14,结合Va>Vb和a=0.5b进行计算和判断.
解答:
解:(1)室温下,在pH=12的溶液呈碱性,该溶液中的溶质可能是碱或强碱弱酸盐;
如果溶质是碱,水电离出的氢氧根离子浓度等于溶液中氢离子浓度,所以由水电离的c(OH-)=c(H+)=10-12 mol/L,
如果溶质是强碱弱酸盐,弱酸根离子易水解而导致溶液呈碱性,则水电离的c(OH-)=
mol/L=0.01mol/L,
故答案为:10-12 mol/L或0.01mol/L;
(2)pH=b的某一元强碱溶液呈碱性,则①7<b<14,
pH=a的强酸c(H+)=10-amol/L,pH=b的强碱c(OH-)=10b-14mol/L,两溶液恰好中和,则有Va×10-a=Vb×10b-14,可得:
=10a+b-14,
Va>Vb,则10a+b-14>1,a+b>14,又a=0.5b,则0.5b+b>14,②b>
,
根据①②可得:
<b<14,
故答案为:
<b<14.
如果溶质是碱,水电离出的氢氧根离子浓度等于溶液中氢离子浓度,所以由水电离的c(OH-)=c(H+)=10-12 mol/L,
如果溶质是强碱弱酸盐,弱酸根离子易水解而导致溶液呈碱性,则水电离的c(OH-)=
| 10-14 |
| 10-12 |
故答案为:10-12 mol/L或0.01mol/L;
(2)pH=b的某一元强碱溶液呈碱性,则①7<b<14,
pH=a的强酸c(H+)=10-amol/L,pH=b的强碱c(OH-)=10b-14mol/L,两溶液恰好中和,则有Va×10-a=Vb×10b-14,可得:
| Va |
| Vb |
Va>Vb,则10a+b-14>1,a+b>14,又a=0.5b,则0.5b+b>14,②b>
| 28 |
| 3 |
根据①②可得:
| 28 |
| 3 |
故答案为:
| 28 |
| 3 |
点评:本题考查了溶液离子浓度的计算、酸碱混合的定性判断,题目难度中等,明确溶液中的溶质及其性质是解本题关键,(1)根据碱溶液或盐溶液结合溶液的pH计算水电离出的氢氧根离子浓度即可,很多同学往往漏掉溶质可能是盐而导致错误,为易错题.

练习册系列答案
相关题目
在一定条件下,既能发生氧化反应,又能发生还原反应的是( )
①乙醇 ②乙醛 ③乙酸 ④葡萄糖.
①乙醇 ②乙醛 ③乙酸 ④葡萄糖.
| A、只有①②④ | B、只有② |
| C、只有②④ | D、只有③④ |
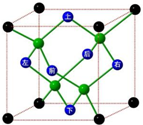 冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:
冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图: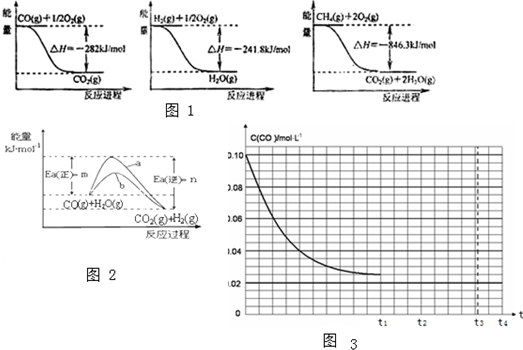
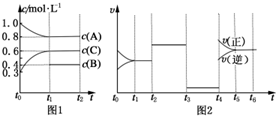 向体积为2L的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)?3C(g)△H>0,各物质的浓度随时间变化的关系如图1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2,t3,t4各改变一种不同的条件.
向体积为2L的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)?3C(g)△H>0,各物质的浓度随时间变化的关系如图1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2,t3,t4各改变一种不同的条件.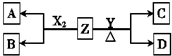 由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如图(其他无关物质已略去).请回答下列问题:
由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如图(其他无关物质已略去).请回答下列问题: