题目内容
把三块金属片浸入稀硫酸中,用导线两两相连组成原电池.若a、b相连时,a为负极;b、c相连时,c不易腐蚀.则三种金属的活动性由强到弱的顺序为( )
| A、a>b>c |
| B、a>c>b |
| C、c>b>a |
| D、b>c>a |
考点:原电池和电解池的工作原理,常见金属的活动性顺序及其应用
专题:电化学专题
分析:形成原电池时,活泼金属做负极,根据电极反应现象首先判断电池的正负极,再判断金属的活泼性强弱,电子从负极沿导线流向正极,据此分析解答.
解答:
解:形成原电池时,活泼金属做负极,若a、b相连时,a为负极;则活泼性a>b,b、c相连时,c不易腐蚀,则c为正极,b为负极,活泼性b>c,
所以三种金属的活泼性顺序为a>b>c,
故选A.
所以三种金属的活泼性顺序为a>b>c,
故选A.
点评:本题考查了原电池工作原理,原电池工作原理和化学电源知识是电化学知识中的重要内容,是历年高考的必考内容,主要考查判断电极、判断离子或电子的移动方向、判断电极上发生的反应类型、判断电极反应式的正误等,所以要重视基础重视的掌握,解题才能游刃有余.

练习册系列答案
相关题目
可逆反应N2+3H2?2NH3的正逆反应速率可用各反应物或生成物浓度的变化来表示.下列关系中能说明反应已达到平衡状态的是( )
| A、2υ正(N2)=υ逆(NH3) |
| B、3υ正(N2)=υ正(H2) |
| C、υ正(H2)=3υ逆(NH3) |
| D、υ正(N2)=3υ逆(H2) |
一定条件下将0.1mol N2和0.3mol H2置于密闭容器中发生反应N2+3H2?2NH3.下列关于该反应的说法正确的是( )
| A、最终可生成0.2 mol NH3 |
| B、使用催化剂不影响反应速率 |
| C、升高温度反应速率增大 |
| D、增大压强反应速率减小 |
下列说法正确的是( )
①非金属氧化物一定是酸性氧化物,碱性氧化物一定是金属氧化物;
②由不同原子组成的纯净物一定是化合物;
③含金属元素的离子不一定都是阳离子;
④一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路;
⑤胆矾是纯净物,水泥是混合物.
①非金属氧化物一定是酸性氧化物,碱性氧化物一定是金属氧化物;
②由不同原子组成的纯净物一定是化合物;
③含金属元素的离子不一定都是阳离子;
④一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路;
⑤胆矾是纯净物,水泥是混合物.
| A、①③④ | B、③④⑤ |
| C、②③④ | D、①②⑤ |
下列电离方程式书写错误的是( )
| A、CaCl2=Ca2++2Cl- |
| B、H2CO3?H++HCO3- |
| C、NaHCO3=Na++H++CO32- |
| D、NaClO=Na++ClO- |
下列实验能获得成功的是( )
| A、乙醇与2mol?L-1的硫酸溶液混合加热到170℃制乙烯 |
| B、苯与溴水反应制取溴苯 |
| C、要鉴别己烯中是否混有少量甲苯,最恰当的实验方法是先加足量的酸性高锰酸钾溶液,然后再加入溴水 |
| D、电石与饱和食盐水作用制乙炔 |
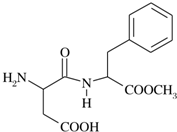 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.