题目内容
15.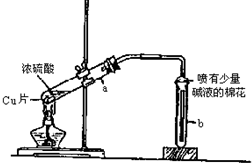 如图为浓硫酸与铜反应的实验装置图.
如图为浓硫酸与铜反应的实验装置图.(1)浓硫酸与铜反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)实验中,若试管b中盛的是紫色石蕊试液,当产生的气体进入试管b中时,石蕊试液将呈红色,原因是SO2溶于水后形成的溶液显酸性.
(3)实验中,若试管b中盛的是品红溶液,当产生的气体进入试管b中时,品红溶液将褪色,原因是SO2具有漂白性.
(4)反应后,将试管a中的液体冷却,将其慢慢倒入另一支盛有少量水的试管中,发现反应后生成物的水溶液呈蓝色,说明铜与浓硫酸反应时被氧化成了Cu2+.
分析 (1)浓硫酸与铜在加热条件下生成反应CuSO4、SO2和H2O;
(2)二氧化硫和水反应生成亚硫酸是中强酸,遇到紫色石蕊试液变红色;
(3)SO2具有漂白性,能使品红溶液褪色;
(4)铜离子的水溶液呈蓝色.
解答 解:(1)浓硫酸与铜在加热条件下生成反应CuSO4、SO2和H2O反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)实验中,若试管b中盛的是紫色石蕊试液,当产生的气体进入试管b中时,石蕊试液将呈红色,二氧化硫和水反应生成亚硫酸是中强酸,遇到紫色石蕊试液变红色,
故答案为:红,SO2溶于水后形成的溶液显酸性;
(3)SO2具有漂白性,能使品红溶液褪色,
故答案为:褪色、SO2具有漂白性.
(4)反应后,将试管a中的液体冷却,将其慢慢倒入另一支盛有少量水的试管中,发现反应后生成物的水溶液呈蓝色说明铜与浓硫酸反应时被氧化成了Cu2+,
故答案为:铜与浓硫酸反应时被氧化成了Cu2+.
点评 本题考查了浓硫酸与铜的反应,二氧化硫的漂白性,题目难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
5.下列物质分子中,所有原子都处于同一平面内的是( )
| A. | CH4 | B. | C6H6 | C. | CH3-CH3 | D. | CH3Cl |
6.下列物质溶于水后由于水解而显酸性的是( )
| A. | NaHSO4 | B. | NaHCO3 | C. | FeCl3 | D. | CH3COOH |
3.下列分子或离子的中心原子,带有一对孤电子对的是( )
| A. | H2O | B. | BeCl2 | C. | CH4 | D. | PCl3 |
10.下列实验不能达到目的是( )
| A. | 用过量NaOH溶液除去镁粉中的铝粉 | B. | AlCl3溶液和氨水制备Al(OH)3沉淀 | ||
| C. | 用盐酸和AgNO3溶液鉴定Cl- | D. | 用加热的方法鉴别Na2CO3和NaHCO3 |
20.下列说法正确的是( )
| A. | 1mol甲烷(CH4)分子中所含电子数为9NA | |
| B. | 24g镁原子的最外层电子数为NA | |
| C. | 在标准状况下,1 mol H2和1mol H2O所占的体积都约是22.4L | |
| D. | 在标准状况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量2mol |
7.下列说法中正确的是( )
| A. | 6.8 g熔融KHSO4 与3.9 g熔融Na2O2 中阴离子数目相同 | |
| B. | 某金属阳离子的结构示意图为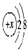 ,其与Cl-形成的强电解质都是离子化合物 ,其与Cl-形成的强电解质都是离子化合物 | |
| C. | 二硫化碳与二氧化碳结构相似,其电子式为 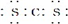 | |
| D. | 中子数为18的氯原子可表示为18Cl |