题目内容
 X、Y、Z、R为前四周期元素,且原子序数依次增大.常温下X的氢化物XH3溶于水PH>7;Y是地壳里含量最多的金属元素,其单质与酸碱均能反应;Z2有毒,其水溶液有漂白性;R基态原子3d轨道的电子数是4S轨道的电子数的3倍,RZ2溶液呈浅绿色.回答下列问题:
X、Y、Z、R为前四周期元素,且原子序数依次增大.常温下X的氢化物XH3溶于水PH>7;Y是地壳里含量最多的金属元素,其单质与酸碱均能反应;Z2有毒,其水溶液有漂白性;R基态原子3d轨道的电子数是4S轨道的电子数的3倍,RZ2溶液呈浅绿色.回答下列问题:(1)Z的基态原子电子排布式为
(2)Z2的晶体类型是
(3)Y单质的晶体晶胞如图,晶胞中Y原子的个数为
(4)向RZ2溶液中滴入Z2的水溶液出现黄色,再滴入周期表中电负性最大的元素形成的钠盐溶液,至溶液呈无色为止,生成一配合物(其中:中心离子数与配体数之比为1:6),写出生成配合物的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、R为前四周期元素,且原子序数依次增大,常温下X的氢化物XH3溶于水pH>7,则X为N元素;Y是地壳里含量最多的金属元素,其单质与酸碱均能反应,则Y为Al元素;Z2有毒,其水溶液有漂白性,则Z为Cl元素;R基态原子3d轨道的电子数是4S轨道的电子数的3倍,RZ2溶液呈浅绿色,则R外围电子排布为3d64s2,故R为Fe元素,据此进行解答.
解答:
解:X、Y、Z、R为前四周期元素,且原子序数依次增大,常温下X的氢化物XH3溶于水pH>7,则X为N元素;Y是地壳里含量最多的金属元素,其单质与酸碱均能反应,则Y为Al元素;Z2有毒,其水溶液有漂白性,则Z为Cl元素;R基态原子3d轨道的电子数是4S轨道的电子数的3倍,RZ2溶液呈浅绿色,则R外围电子排布为3d64s2,故R为Fe元素,
(1)Z为Cl元素,氯原子的核外电子总数为17,最外层为7个电子,氯原子的基态原子电子排布式为:1s22s22p63s23p5或[Ne]3s23p5 ;
X为N元素,位于周期表中第二周期,第二周期中原子半径最大的主族元素为Li,
故答案为:1s22s22p63s23p5或[Ne]3s23p5 ;Li或锂;
(2)Z为Cl元素,Z2为Cl2,氯气的晶体类型为分子晶体;XZ3为NCl3,类比NH3分子结构,NCl3的立体构型为三角锥形,
故答案为:分子晶体;三角锥形;
(3)Y为Al元素,铝单质的晶体晶胞如图,晶胞中R原子处于晶胞的面心及顶角,该晶胞中所含的原子个数为:6×
+8×
=4,
故答案为:4;
(4)RZ2为氯化亚铁,向FeCl2溶液中滴入Cl2的水溶液出现黄色,反应生成氯化铁;再滴入周期表中电负性最大的元素F形成的钠盐溶液,至溶液呈无色为止,生成一配合物(其中:中心离子数与配体数之比为1:6),该化合物为[FeF6]3-,生成配合物的离子方程式为:6F-+Fe3+═[FeF6]3-,
故答案为:6F-+Fe3+═[FeF6]3-.
(1)Z为Cl元素,氯原子的核外电子总数为17,最外层为7个电子,氯原子的基态原子电子排布式为:1s22s22p63s23p5或[Ne]3s23p5 ;
X为N元素,位于周期表中第二周期,第二周期中原子半径最大的主族元素为Li,
故答案为:1s22s22p63s23p5或[Ne]3s23p5 ;Li或锂;
(2)Z为Cl元素,Z2为Cl2,氯气的晶体类型为分子晶体;XZ3为NCl3,类比NH3分子结构,NCl3的立体构型为三角锥形,
故答案为:分子晶体;三角锥形;
(3)Y为Al元素,铝单质的晶体晶胞如图,晶胞中R原子处于晶胞的面心及顶角,该晶胞中所含的原子个数为:6×
| 1 |
| 2 |
| 1 |
| 8 |
故答案为:4;
(4)RZ2为氯化亚铁,向FeCl2溶液中滴入Cl2的水溶液出现黄色,反应生成氯化铁;再滴入周期表中电负性最大的元素F形成的钠盐溶液,至溶液呈无色为止,生成一配合物(其中:中心离子数与配体数之比为1:6),该化合物为[FeF6]3-,生成配合物的离子方程式为:6F-+Fe3+═[FeF6]3-,
故答案为:6F-+Fe3+═[FeF6]3-.
点评:本题考查结构性质位置关系综合应用,题目难度中等,试题涉及化学键、晶胞计算、配合物、离子方程式等,推断元素名称为解题关键,注意掌握原子结构与元素周期表、元素周期律的关系.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案
相关题目
下列关于铜、铝、铁的说法,正确的是( )
| A、三种金属常温下均不溶于足量的浓硝酸中 |
| B、三种金属久置于潮湿的空气中均能生成氧化物而生锈 |
| C、三种金属均能与硫反应,分别生成Cu2S、Al2S3、FeS |
| D、三种金属的还原性:Al>Fe>Cu;离子的氧化性:Cu2+>Fe3+>Al3+ |
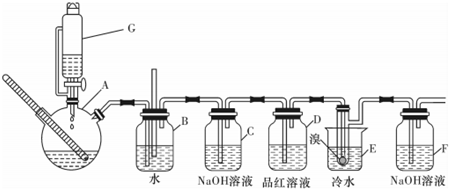
下列实验装置(固定装置略去)和操作正确的是( )

| A、①③ | B、②④ | C、①④ | D、②③ |
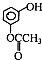
 ,则不含苯环的有机产物的结构简式为
,则不含苯环的有机产物的结构简式为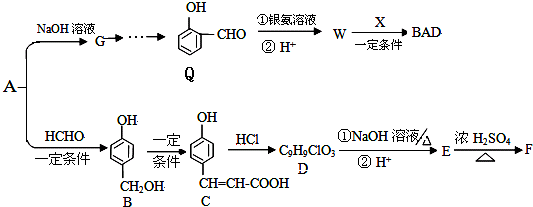
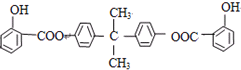
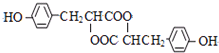
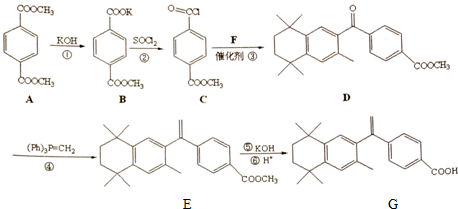
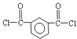 )发生缩聚反应生成一种聚芳酯和氯化氢,写出该聚芳酯的结构简式
)发生缩聚反应生成一种聚芳酯和氯化氢,写出该聚芳酯的结构简式