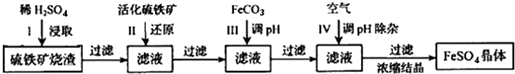
题目内容
3.根据反应:2KClO3+I2═2KIO3+Cl2↑判断,下列结论不正确的是( )| A. | 该反应属于置换反应 | B. | I2具有还原性 | ||
| C. | 当生成1mol Cl2时转移2mol电子 | D. | 氧化剂是KClO3 |
分析 2KClO3+I2=2KIO3+Cl2↑中,Cl元素的化合价由+5价降低为0,I元素的化合价由0升高为+5价,以此来解答.
解答 解:A.该反应为单质与化合物反应生成新单质与新化合物的反应,属于置换反应,故A正确;
B.I元素的化合价升高,I2具有还原性,故B正确;
C.当生成1mol Cl2时,转移1mol×2×(5-0)=10mol电子,故C错误;
D.Cl元素的化合价降低,则氧化剂是KClO3,故D正确;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
13.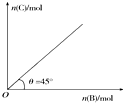 盛有足量A的体积固定的密闭容器中加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.一定条件下达到平衡时,C的物质的量与加入的B的物质的量的变化关系如图所示.下列说法不正确的是( )
盛有足量A的体积固定的密闭容器中加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.一定条件下达到平衡时,C的物质的量与加入的B的物质的量的变化关系如图所示.下列说法不正确的是( )
 盛有足量A的体积固定的密闭容器中加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.一定条件下达到平衡时,C的物质的量与加入的B的物质的量的变化关系如图所示.下列说法不正确的是( )
盛有足量A的体积固定的密闭容器中加入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H<0.一定条件下达到平衡时,C的物质的量与加入的B的物质的量的变化关系如图所示.下列说法不正确的是( )| A. | 降低温度,则图中θ>45° | |
| B. | 平衡后再加入B,正反应速率增大,逆反应速率减小 | |
| C. | 平衡时B的转化率为50% | |
| D. | 平衡后再加入A,体系内气体密度不变 |
11.下列离子方程式正确的是( )
| A. | 用Al作电极电解NaHCO3溶液:2Al+6H2O═2Al(OH)3↓+3H2↑ | |
| B. | 向明矾溶液中加入氢氧化钡溶液至沉淀质量最大时:2Al3++2SO42-+2Ba2++6OH-═2BaSO4↓+2Al(OH)3↓ | |
| C. | 碳酸钠的水解反应:CO32-+H3O+═HCO3-+H2O | |
| D. | 酸性高锰酸钾溶液与双氧水反应:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O |
15.下列说法正确的是( )
| A. | 16O和18O原子的核外电子排布不相同 | |
| B. | 含有离子键的化合物一定是离子化合物 | |
| C. | HF、HCl、HBr、HI的熔沸点逐渐升高 | |
| D. | 干冰和二氧化硅熔化时所克服微粒间的相互作用相同 |
 ;反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O;已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
;反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O;已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.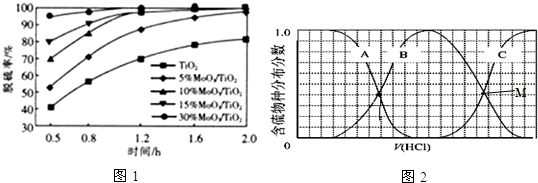
 密闭容器中,能说明反应:2N02(g)
密闭容器中,能说明反应:2N02(g) 2NO(g)+02(g)达到平衡
2NO(g)+02(g)达到平衡 状态的是 ( )
状态的是 ( )