题目内容
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、7.8g Na2O2中含有的离子总数目为0.4NA |
| B、1mol苯分子中含有碳碳双键数目为3NA |
| C、标准状况下,将分子总数为NA的NH3和HCl气体混合后的体积约为22.4L |
| D、16g CH4与18g NH4+所含电子数均为10NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、过氧化钠中的阴离子为过氧根离子,0.1mol过氧化钠中含有0.1mol阴离子、0.2mol钠离子;
B、苯分子的碳碳键为一种独特键,其分子中不存在碳碳双键;
C、氨气与氯化氢混合后发生反应生成氯化铵,所以二者混合后气体体积减小;
D、16g甲烷的物质的量为1mol,含有10mol电子;18g铵离子的物质的量为1mol,含有10mol电子.
B、苯分子的碳碳键为一种独特键,其分子中不存在碳碳双键;
C、氨气与氯化氢混合后发生反应生成氯化铵,所以二者混合后气体体积减小;
D、16g甲烷的物质的量为1mol,含有10mol电子;18g铵离子的物质的量为1mol,含有10mol电子.
解答:
解:A、7.8g过氧化钠的物质的量为0.1mol,0.1mol过氧化钠中含有0.1mol过氧根离子、0.2mol钠离子,总共含有0.3mol离子,含有的离子总数目为0.3NA,故A错误;
B、苯分子中的碳碳键是一种介于单键和双键之间的独特键,不存在碳碳双键,故B错误;
C、分子总数为NA的气体的物质的量为1mol,由于氯化氢和氨气发生反应生成氯化铵晶体,所以二者混合后气体体积减小,一定小于22.4L,故C错误;
D、甲烷和铵离子都是10电子粒子,16g甲烷的物质的量为1mol,18g铵离子的物质的量为1mol,二者都含有10mol电子,所含电子数均为10NA,故D正确;
故选D.
B、苯分子中的碳碳键是一种介于单键和双键之间的独特键,不存在碳碳双键,故B错误;
C、分子总数为NA的气体的物质的量为1mol,由于氯化氢和氨气发生反应生成氯化铵晶体,所以二者混合后气体体积减小,一定小于22.4L,故C错误;
D、甲烷和铵离子都是10电子粒子,16g甲烷的物质的量为1mol,18g铵离子的物质的量为1mol,二者都含有10mol电子,所含电子数均为10NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意过氧化钠中的阴离子为过氧根离子;注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
下列有关实验装置进行的相应实验,能达到实验目的是( )
A、 装置可用于定量测定H2O2的分解速率 装置可用于定量测定H2O2的分解速率 |
B、 装置制备Fe(OH)2并能较长时间观察其颜色 装置制备Fe(OH)2并能较长时间观察其颜色 |
C、 装置测量Cu与浓硝酸反应产生气体的体积 装置测量Cu与浓硝酸反应产生气体的体积 |
D、 装置可用于蒸干NH4Cl饱和溶液制备NH4Cl晶体 装置可用于蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
设NA代表阿佛加德罗常数,下列说法正确的是( )
| A、22.4LCO和CO2的混合气体中所含的碳原子数一定是NA |
| B、含1mol HCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为2NA |
| C、常温常压下,32g O2和32g O3所含氧原子数都是2NA |
| D、标准状况下,11.2L H2O含有0.5NA分子 |
以NA表示阿佛加德罗常数,下列说法中正确的是( )
| A、53g碳酸钠中含NA个CO32- |
| B、0.1molOH-含NA个电子 |
| C、1.8gD2O中含NA个中子 |
| D、11.2L氧气中含NA个氧原子 |
用下列有关实验装置进行相应实验,能达到实验目的是( )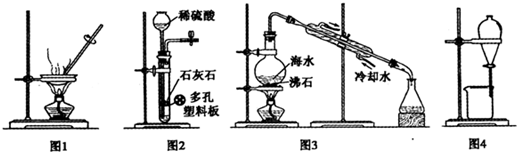

| A、用图1装置蒸干CuCl2饱和溶液制备CuCl2晶体 |
| B、用图2装置制取二氧化碳气体 |
| C、用图3装置蒸馏海水制取少量淡水 |
| D、用图4装置分离乙醇与乙酸乙酯的混合物 |
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是( )
| A、使酚酞变红色的溶液:Na+、Ba2+、I-、Cl- | ||
| B、使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42- | ||
C、含有0.1 mol?L-1 Fe3+的溶液:Na+、K+、SCN-、NO
| ||
| D、由水电离产生的c(H+)=10-12mol?L-1的溶液:NH4+、SO42-、HCO3-、Cl- |