题目内容
4. 煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料.
煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料.(1)一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),下列选项能判断该反应达到平衡状态的依据的有BD.
A.v(H2)=2v(CO)
B.平衡常数K不再随时间而变化
C.混合气体的密度保持不变
D.混合气体的平均相对分子质量不随时间而变化
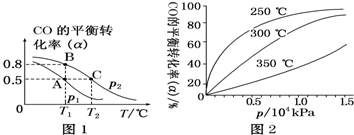
(2)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+2H2(g)??CH3OH(g),在一容积可变的密闭容器中充有10mol CO和20mol H2,在催化剂作用下发生反应生成甲醇.CO的平衡转化率(α)与温度(T )、压强(p)的关系如图1所示.
①合成甲醇的反应为放热(填“放热”或“吸热”)反应.
②A、B、C三点的平衡常数KA、KB、KC的大小关系为KA=KB>KC,p1和p2的大小关系为P1<P2.
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为2 L.
④CO的平衡转化率(α)与温度(T )、压强(p)的关系如图2所示,实际生产时条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是在1.3×104Pa下,CO的转化率已较高,再增大压强,CO的转化率提高不大,生产成本却增加.
分析 (1)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)①由图1可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动;
②平衡常数与浓度、压强无关,只与温度有关,结合平衡移动判断;增大压强平衡正移,CO的转化率增大;
③A、B两点温度相等,压强不同,平衡常数相同,利用三段式计算A、B两点平衡时各组分物质的量,根据A点各物质的浓度计算平衡常数,再根据平衡常数计算B点体积;
④由图3可知,在250°C、1.3x104kPa左右,时CO的转化率已较高,再增大压强CO转化率提高不大,且增大成本.
解答 解:(1)A.2v(H2)=v (CO)中未指明正逆速率,不能说明得到平衡,故A错误;
B.平衡常数与浓度、压强无关,只与温度有关,温度一定时平衡常数为定值,绝热密闭容器中,容器中的温度随着反应进行不断变化,则平衡常数不断变化,当平衡常数不变时说明达到了平衡状态,故B正确;
C.容器体积不变,混合气体总质量不变,混合气体密度始终保持不变,不能说明得到平衡,故C错误;
D.混合气体总质量不变,随反应进行气体物质的量减小,混合气体平均相对分子质量减小,当混合气体的平均相对分子质量不随时间而变化,说明反应到达平衡,故D正确,
故答案为:BD;
(2)①由图1可知,压强一定时,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,即正反应为放热反应,故答案为:放热;
②平衡常数与压强无关,只与温度有关,A、B温度相等,则KA=KB,相同压强下,温度越高CO的转化率越小,说明升高温度平衡向逆反应方向移动,则平衡常数减小,故KB>KC,故KA=KB>KC;增大压强平衡正移,CO的转化率增大,已知P2条件下,CO的转化率大,则P1<P2;
故答案为:KA=KB>KC; P1<P2;
③A、B两点温度相等,压强不同,平衡常数相同,
对应A点,CO转化率为0.5,参加反应CO为10mol×0.5=5mol,
CO(g)+2H2(g)?CH3OH(g)
开始(mol):10 20 0
转化(mol):5 10 5
平衡(mol):5 10 5
故T1温度下,平衡常数K=$\frac{\frac{5}{10}}{\frac{5}{10}×(\frac{10}{10})^{2}}$=1
对应B点,CO转化率为0.8,参加反应CO为10mol×0.8=8mol,
CO(g)+2H2(g)?CH3OH(g)
开始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设平衡时的体积为VL,则$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{4}{V})^{2}}$=1,解得V=2
故答案为:2;
④由图3可知,在250°C、1.3x104kPa左右,CO的转化率已较高,再增大压强CO转化率提高不大,且增大生成成本,得不偿失,故选择250°C、1.3x104kPa左右,
故答案为:在1.3×104Pa下,CO的转化率已较高,再增大压强,CO的转化率提高不大,生产成本却增加.
点评 本题考查化学平衡常数有关计算、化学平衡图象及影响因素、化学平衡状态判断、反应热计算,注意掌握化学平衡常数的应用,掌握三段式计算方法,难度中等.

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案| A. | 稀有气体元素 | |
| B. | 过渡元素 | |
| C. | 氟、氯、硫、磷元素 | |
| D. | 金属元素和非金属元素分界线附近的元素 |
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 核素指一种原子,而元素是指一类原子;核素间互称同位素,元素包含同位素 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们是互为同位素 |
| A. | 氧元素位于第2周期VIA族 | |
| B. | 元素周期表中有7个主族、7个副族 | |
| C. | 稀有气体元素原子的最外层电子数均为8 | |
| D. | 铷、氯、锗三种元素中,适合作半导体材料的是锗 |
| A. | 金属元素和非金属元素交界处最容易找到制催化剂的材料 | |
| B. | 电能是现代社会中应用最广泛、最方便的一次能源 | |
| C. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| D. | 煤块粉碎为煤粉的目的是提高煤的燃烧效率 |
| A. | 质子 | B. | 电子 | C. | ${\;}_{1}^{1}$H+ | D. | 中子 |
 Fe3++SO32﹣+H2O→2Fe2++SO42﹣+2H+
Fe3++SO32﹣+H2O→2Fe2++SO42﹣+2H+