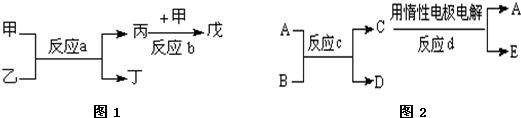
��Ŀ����
CO�dz����Ļ�ѧ���ʣ��ڹ�ҵ��������;�ܹ㷺��
��1����֪��ijЩ��Ӧ���Ȼ�ѧ����ʽ���£�
2H2��g��+SO2��g��=S��g��+2H2O��g����H=+90.4kJ?mol-1
2CO��g��+O2��g��=2CO2��g����H=-556.0kJ?mol-1
2H2��g��+O2��g��=2H2O��g����H=-483.6kJ?mol-1
��д����CO��ȥ������SO2������S��g����CO2�Ȼ�ѧ����ʽ
��2��ijȼ�ϵ����COΪȼ�ϣ��Կ���Ϊ��������������̬��K2CO3Ϊ����ʣ���д����ȼ�ϵ�������ĵ缫��Ӧʽ ��
��3����ij�¶��¡��ݻ���Ϊ2L�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��º��ݣ�ʹ֮������Ӧ��2H2��g��+CO��g��?CH3OH��g������H=-dJ?mol-1��d��0������ʼͶ����������ﵽƽ��ʱ���й��������£�
�ٸ��¶��´˷�Ӧ��ƽ�ⳣ��KΪ ��
�����������еķ�Ӧ�ֱ��ƽ��ʱ�������ݹ�ϵ��ȷ���� ������ţ���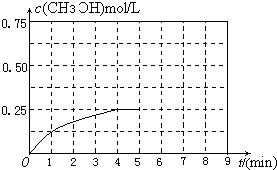
A����1+��2=1 B��Q1+Q2=dC����3����1 D��P3��2P1=2P2E��n2��n3��1.0mol F��Q3��2Q1
���������������������£�������������ϵ���ѹ����1L�����ڵ�8min�ﵽ�µ�ƽ�⣬�ӿ�ʼ����ƽ��ʱH2��ת����Ϊ65.5%��������ͼ�л�����5min ����ƽ��ʱCH3OH�����ʵ���Ũ�ȵı仯���ߣ�
��4��ʵ���ҳ��ü��ᣨһԪ�ᣩ���Ʊ�CO����֪25��ʱ��0��l mol/L���ᣨ HCOOH����Һ��0��l mo1/L������Һ��pH�ֱ�Ϊ2.3��2.9��������ͬ���ʵ���Ũ�ȵ�����������Һ����HCOONa��Һ ��CH3COONa��Һ��Na2CO3��NaHCO3��Һ����pH�ɴ�С��˳���� ����д��Һ��ţ�������0��l mo1/L HCOOH��Һ��0��l mo1/LHCOONa�������Ϻ����Һ������ȷ���� ��
a��c��HCOO������c��HCOOH����c��Na+����c��H+��
b��c��HCOO����+c��HCOOH��=0.2mo1/L
c��c��HCOO����+2c��OH����=c��HCOOH��+2c��H+��
d��c��HCOO������c��Na+����c��H+����c��OH����
��1����֪��ijЩ��Ӧ���Ȼ�ѧ����ʽ���£�
2H2��g��+SO2��g��=S��g��+2H2O��g����H=+90.4kJ?mol-1
2CO��g��+O2��g��=2CO2��g����H=-556.0kJ?mol-1
2H2��g��+O2��g��=2H2O��g����H=-483.6kJ?mol-1
��д����CO��ȥ������SO2������S��g����CO2�Ȼ�ѧ����ʽ
��2��ijȼ�ϵ����COΪȼ�ϣ��Կ���Ϊ��������������̬��K2CO3Ϊ����ʣ���д����ȼ�ϵ�������ĵ缫��Ӧʽ
��3����ij�¶��¡��ݻ���Ϊ2L�������ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��º��ݣ�ʹ֮������Ӧ��2H2��g��+CO��g��?CH3OH��g������H=-dJ?mol-1��d��0������ʼͶ����������ﵽƽ��ʱ���й��������£�
| ʵ�� | �� | �� | �� |
| ��ʼͶ�� | 2molH2��1molCO | 1mol CH3OH | 4molH2��2molCO |
| ƽ��ʱn��CH3OH �� | 0.5mol | n2 | n3 |
| ��Ӧ�������仯 | �ų�Q1kJ | ����Q2kJ | �ų�Q3kJ |
| ��ϵ��ѹǿ | P1 | P2 | P3 |
| ��Ӧ���ת���� | ��1 | ��2 | ��3 |
�����������еķ�Ӧ�ֱ��ƽ��ʱ�������ݹ�ϵ��ȷ����

A����1+��2=1 B��Q1+Q2=dC����3����1 D��P3��2P1=2P2E��n2��n3��1.0mol F��Q3��2Q1
���������������������£�������������ϵ���ѹ����1L�����ڵ�8min�ﵽ�µ�ƽ�⣬�ӿ�ʼ����ƽ��ʱH2��ת����Ϊ65.5%��������ͼ�л�����5min ����ƽ��ʱCH3OH�����ʵ���Ũ�ȵı仯���ߣ�
��4��ʵ���ҳ��ü��ᣨһԪ�ᣩ���Ʊ�CO����֪25��ʱ��0��l mol/L���ᣨ HCOOH����Һ��0��l mo1/L������Һ��pH�ֱ�Ϊ2.3��2.9��������ͬ���ʵ���Ũ�ȵ�����������Һ����HCOONa��Һ ��CH3COONa��Һ��Na2CO3��NaHCO3��Һ����pH�ɴ�С��˳����
a��c��HCOO������c��HCOOH����c��Na+����c��H+��
b��c��HCOO����+c��HCOOH��=0.2mo1/L
c��c��HCOO����+2c��OH����=c��HCOOH��+2c��H+��
d��c��HCOO������c��Na+����c��H+����c��OH����
���㣺��ѧƽ��ļ���,�ø�˹���ɽ����йط�Ӧ�ȵļ���,ԭ��غ͵��صĹ���ԭ��
ר�⣺
��������1�����ݸ�˹�����жϣ�
��2��ȼ�ϵ���У����������ķ�Ӧһ���������õ��ӵĹ��̣������������̼����Ϊ����ʣ�����ѭ�����õ�����ֻ�ж�����̼��
��3��������Ӧ��CO��g��+2H2��g��?CH3OH��g����
����������ʽ����ƽ��ʱ����ֵ�ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ����ƽ�ⳣ����
��A���ס���Ϊ��Чƽ�⣬ƽ��ʱCO�����ʵ�����ȣ���ƽ��ʱCOΪamol����ʾ������COת���ʡ����м״���ת���ʣ��ݴ˼����жϣ�
B���ס���Ϊ��Чƽ�⣬ƽ��ʱCO�����ʵ�����ȣ���ƽ��ʱCOΪbmol�������Ȼ�ѧ����ʽ��ʾ�����зų�����Q1���������յ�����Q2���ݴ˼����жϣ�
C���������ȣ����Ե�ЧΪ�ڼĻ����ϣ�ѹǿ����һ����
D���ס���Ϊ��Чƽ�⣬ƽ��ʱ��Ӧ����ֵ����ʵ�����ȣ�����ѹǿ��Ч���������ȣ����Ե�ЧΪ�ڼĻ����ϣ�ѹǿ����һ����ƽ��������Ӧ�ƶ���ƽ��ʱ�����������ʵ���С�ڼ��е�2����
E�����D�еķ������
F���������ȣ����Ե�ЧΪ�ڼĻ����ϣ�ѹǿ����һ����ƽ��������Ӧ�ƶ������вμӷ�Ӧ��CO�����ʵ������ڼ��е�2����
�۸�����֪��������״���5min��8minʱ�����ʵ���Ũ�ȣ�Ȼ������ͼ���ɣ�
��4�����������ˮ��̶���ȷ����Һ��pH��С���������Խ��������������ˮ��̶�Խ������ͬŨ�ȵ�������Һ��pHԽ��
��2��ȼ�ϵ���У����������ķ�Ӧһ���������õ��ӵĹ��̣������������̼����Ϊ����ʣ�����ѭ�����õ�����ֻ�ж�����̼��
��3��������Ӧ��CO��g��+2H2��g��?CH3OH��g����
����������ʽ����ƽ��ʱ����ֵ�ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ����ƽ�ⳣ����
��A���ס���Ϊ��Чƽ�⣬ƽ��ʱCO�����ʵ�����ȣ���ƽ��ʱCOΪamol����ʾ������COת���ʡ����м״���ת���ʣ��ݴ˼����жϣ�
B���ס���Ϊ��Чƽ�⣬ƽ��ʱCO�����ʵ�����ȣ���ƽ��ʱCOΪbmol�������Ȼ�ѧ����ʽ��ʾ�����зų�����Q1���������յ�����Q2���ݴ˼����жϣ�
C���������ȣ����Ե�ЧΪ�ڼĻ����ϣ�ѹǿ����һ����
D���ס���Ϊ��Чƽ�⣬ƽ��ʱ��Ӧ����ֵ����ʵ�����ȣ�����ѹǿ��Ч���������ȣ����Ե�ЧΪ�ڼĻ����ϣ�ѹǿ����һ����ƽ��������Ӧ�ƶ���ƽ��ʱ�����������ʵ���С�ڼ��е�2����
E�����D�еķ������
F���������ȣ����Ե�ЧΪ�ڼĻ����ϣ�ѹǿ����һ����ƽ��������Ӧ�ƶ������вμӷ�Ӧ��CO�����ʵ������ڼ��е�2����
�۸�����֪��������״���5min��8minʱ�����ʵ���Ũ�ȣ�Ȼ������ͼ���ɣ�
��4�����������ˮ��̶���ȷ����Һ��pH��С���������Խ��������������ˮ��̶�Խ������ͬŨ�ȵ�������Һ��pHԽ��
���
�⣺��1���ɢ�2H2��g��+SO2��g��=S��g��+2H2O��g����H=+90.4kJ?mol-1
��2CO��g��+O2��g��=2CO2��g����H=-556.0kJ?mol-1
��2H2��g��+O2��g��=2H2O��g����H=-483.6kJ?mol-1��
���ݸ�˹���ɷ�Ӧ��+��-�ۿɵõ�2CO��g��+SO2��g��=S��g��+2CO2��g����H=+18.0kJ?mol-1��
�ʴ�Ϊ��2CO��g��+SO2��g��=S��g��+2CO2��g����H=+18.0kJ?mol-1��
��2���õ���У�������Ӧһ���������õ��ӵĹ��̣��õ�صĵ���ʻ���������̼���Σ����Ե缫��ӦΪ��O2+2CO2+4e-=2CO32- ����2O2+4CO2+8e-=4CO32-����
�ʴ�Ϊ��O2+4e-+2CO2�T2CO32-��
��3����CO����ʼŨ��=
=0.5mol/L����������ʼŨ��=
=1mol/L���ﵽƽ��ʱc��CH3OH��=
=0.25mol/L����
CO��g��+2H2��g��?CH3OH��g��
��ʼ��mol/L����0.5 1 0
�仯��mol/L����0.25 0.5 0.25
ƽ�⣨mol/L����0.25 0.5 0.25
���ԣ�ƽ�ⳣ��K=
=4��
�ʴ�Ϊ��4��
��A���ס���Ϊ��Чƽ�⣬ƽ��ʱCO�����ʵ�����ȣ���ƽ��ʱCOΪamol������COת���ʦ�1=
=1-a��ƽ��ʱ�״������ʵ���=��1-a��mol�����вμӷ�Ӧ�ļ״�Ϊamol�����е�ת���ʦ�2=a���ʦ�1+��2=1����A��ȷ��
B���ס���Ϊ��Чƽ�⣬ƽ��ʱCO�����ʵ�����ȣ���ƽ��ʱCOΪbmol������вμӷ�Ӧ��COΪ��1-b��mol���ų�������Q1=d��1-b�������вμӷ�Ӧ�ļ״�Ϊbmol�����յ�����Q2=bd����Q1+Q2=d��1-b��+bd=d����B��ȷ��
C���������ȣ����Ե�ЧΪ�ڼĻ����ϣ�ѹǿ����һ����ƽ��������Ӧ�����ƶ���ת����������3����1 ����C����
D���ס���Ϊ��Чƽ�⣬ƽ��ʱ��Ӧ����ֵ����ʵ�����ȣ�����ѹǿ��Ч���������ȣ����Ե�ЧΪ�ڼĻ����ϣ�ѹǿ����һ����ƽ��������Ӧ�ƶ���ƽ��ʱ�����������ʵ���С�ڼ��е�2������ѹǿP3��2P1=2P2 ����D����
E����D�з�����֪��n2=0.5��n3��1.0mol����E����
F���������ȣ����Ե�ЧΪ�ڼĻ����ϣ�ѹǿ����һ����ƽ��������Ӧ�ƶ������вμӷ�Ӧ��CO�����ʵ������ڼ��е�2������Q3��2Q1����F����
�ʴ�Ϊ��AB��
�۽�����������ϵ���ѹ����1L�����ڵ�8min �ﵽ�µ�ƽ��ʱ��
2H2��g��+CO��g��?CH3OH��g��
��ʼ����mol����2 1 0
�仯����mol����1.31 0.652 0.652
ƽ������mol����0.69 0.348 0.652
���Դﵽƽ��ʱ���״������ʵ���Ũ����0.652mol/L���ڵ�5minʱ������������룬���Լ״���Ũ��Ӧ�üӱ�����Ϊ0.25mol/L��2=0.5mol/L������5-8min�ڣ��״������ʵ���Ũ�ȴ�0.5mol/L���ߵ�0.652mol/L����ͼ��ʾ��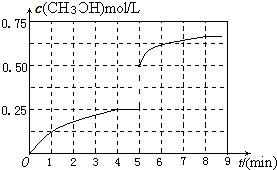 ��
��
�ʴ�Ϊ�� ��
��
��4��ǿ���������ж�Ӧ������Խǿ��ˮ��̶�ԽС��̼�������С�ڴ���ģ���ҺpH�Ĵ�С˳���Ǣۢܢڢ٣�
0��l mo1/L HCOOH��Һ��0��l mo1/LHCOONa�������Ϻ����Һ�У�����ĵ���̶ȴ��ڼ����Ƶ�ˮ��̶ȣ�
a������ĵ���̶ȴ��ڼ����Ƶ�ˮ��̶ȣ�c��Na+����c��HCOOH������a����
b������Ժ�����ӱ������������غ�c��HCOO����+c��HCOOH��=0.1mo1/L=2c��Na+������b����
c���������غ�͵���غ��������ɵ�c��HCOO����+2c��OH����=c��HCOOH��+2c��H+������c��ȷ��
d�����ݵ���غ�c��HCOO����+c��OH����=c��Na+��+c��H+������Һ�����ԣ�����c��H+����c��OH��������c��HCOO������c��Na+����c��H+����c��OH��������d��ȷ��
�ʴ�Ϊ���ۢܢڢ٣�cd��
��2CO��g��+O2��g��=2CO2��g����H=-556.0kJ?mol-1
��2H2��g��+O2��g��=2H2O��g����H=-483.6kJ?mol-1��
���ݸ�˹���ɷ�Ӧ��+��-�ۿɵõ�2CO��g��+SO2��g��=S��g��+2CO2��g����H=+18.0kJ?mol-1��
�ʴ�Ϊ��2CO��g��+SO2��g��=S��g��+2CO2��g����H=+18.0kJ?mol-1��
��2���õ���У�������Ӧһ���������õ��ӵĹ��̣��õ�صĵ���ʻ���������̼���Σ����Ե缫��ӦΪ��O2+2CO2+4e-=2CO32- ����2O2+4CO2+8e-=4CO32-����
�ʴ�Ϊ��O2+4e-+2CO2�T2CO32-��
��3����CO����ʼŨ��=
| 1mol |
| 2L |
| 2mol |
| 2L |
| 0.5mol |
| 2L |
CO��g��+2H2��g��?CH3OH��g��
��ʼ��mol/L����0.5 1 0
�仯��mol/L����0.25 0.5 0.25
ƽ�⣨mol/L����0.25 0.5 0.25
���ԣ�ƽ�ⳣ��K=
| 0.25 |
| 0.25��0��52 |
�ʴ�Ϊ��4��
��A���ס���Ϊ��Чƽ�⣬ƽ��ʱCO�����ʵ�����ȣ���ƽ��ʱCOΪamol������COת���ʦ�1=
| 1-a |
| 1 |
B���ס���Ϊ��Чƽ�⣬ƽ��ʱCO�����ʵ�����ȣ���ƽ��ʱCOΪbmol������вμӷ�Ӧ��COΪ��1-b��mol���ų�������Q1=d��1-b�������вμӷ�Ӧ�ļ״�Ϊbmol�����յ�����Q2=bd����Q1+Q2=d��1-b��+bd=d����B��ȷ��
C���������ȣ����Ե�ЧΪ�ڼĻ����ϣ�ѹǿ����һ����ƽ��������Ӧ�����ƶ���ת����������3����1 ����C����
D���ס���Ϊ��Чƽ�⣬ƽ��ʱ��Ӧ����ֵ����ʵ�����ȣ�����ѹǿ��Ч���������ȣ����Ե�ЧΪ�ڼĻ����ϣ�ѹǿ����һ����ƽ��������Ӧ�ƶ���ƽ��ʱ�����������ʵ���С�ڼ��е�2������ѹǿP3��2P1=2P2 ����D����
E����D�з�����֪��n2=0.5��n3��1.0mol����E����
F���������ȣ����Ե�ЧΪ�ڼĻ����ϣ�ѹǿ����һ����ƽ��������Ӧ�ƶ������вμӷ�Ӧ��CO�����ʵ������ڼ��е�2������Q3��2Q1����F����
�ʴ�Ϊ��AB��
�۽�����������ϵ���ѹ����1L�����ڵ�8min �ﵽ�µ�ƽ��ʱ��
2H2��g��+CO��g��?CH3OH��g��
��ʼ����mol����2 1 0
�仯����mol����1.31 0.652 0.652
ƽ������mol����0.69 0.348 0.652
���Դﵽƽ��ʱ���״������ʵ���Ũ����0.652mol/L���ڵ�5minʱ������������룬���Լ״���Ũ��Ӧ�üӱ�����Ϊ0.25mol/L��2=0.5mol/L������5-8min�ڣ��״������ʵ���Ũ�ȴ�0.5mol/L���ߵ�0.652mol/L����ͼ��ʾ��
 ��
���ʴ�Ϊ��
 ��
����4��ǿ���������ж�Ӧ������Խǿ��ˮ��̶�ԽС��̼�������С�ڴ���ģ���ҺpH�Ĵ�С˳���Ǣۢܢڢ٣�
0��l mo1/L HCOOH��Һ��0��l mo1/LHCOONa�������Ϻ����Һ�У�����ĵ���̶ȴ��ڼ����Ƶ�ˮ��̶ȣ�
a������ĵ���̶ȴ��ڼ����Ƶ�ˮ��̶ȣ�c��Na+����c��HCOOH������a����
b������Ժ�����ӱ������������غ�c��HCOO����+c��HCOOH��=0.1mo1/L=2c��Na+������b����
c���������غ�͵���غ��������ɵ�c��HCOO����+2c��OH����=c��HCOOH��+2c��H+������c��ȷ��
d�����ݵ���غ�c��HCOO����+c��OH����=c��Na+��+c��H+������Һ�����ԣ�����c��H+����c��OH��������c��HCOO������c��Na+����c��H+����c��OH��������d��ȷ��
�ʴ�Ϊ���ۢܢڢ٣�cd��
���������⿼���Ϊ�ۺϣ��漰��ѧƽ��ļ��㡢ԭ��صȣ���Ŀ�ѶȽϴ�3���Т���Ϊ�״��㣬Ҫȷ�����Чƽ�����⣬ע��Խ��۵��������գ�

��ϰ��ϵ�д�
�����Ŀ
����˵����ȷ���ǣ�������
| A��������ԭ��Ӧ�У�һ��Ԫ�ػ��ϼ�������һ������һ��Ԫ�ػ��ϼ��½� |
| B�������ᡢ���ˮ�����ֱ������ᡢ��� |
| C���Ӵ����������У�Ϊ���SO2��ת���ʣ��Ӵ����ڷ�Ӧ�¶�ѡ����400�桫500�� |
| D��ij����ֻ����һ��Ԫ�أ�������ʿ���Ϊ����� |
��ˮ��Һ���ܳ��������һ�������ǣ�������
| A��H+��I-��NO3-��SiO32- |
| B��K+��SO42-��Cu2+��NO3- |
| C��Ag+��Fe3+��Cl-��SO42- |
| D��NH4+��OH-��Cl-��HCO3- |
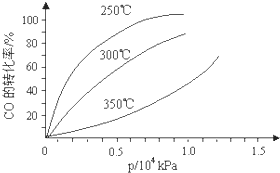 CO�����ںϳɼ״�����Ӧ����ʽΪCO��g��+2H2��g��?CH3OH��g����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ���÷�Ӧ��H
CO�����ںϳɼ״�����Ӧ����ʽΪCO��g��+2H2��g��?CH3OH��g����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ���÷�Ӧ��H