题目内容
有①-⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素.
(1)若②、⑦、⑧三种元素在周期表中相对位置如下:
已知②形成的化合物种类最多,②与⑧形成的液体化合物是常见的溶剂,则⑦元素在周期表中的位置是 ,②与⑧形成的化合物中存在的化学键是 ,⑦、⑧两种元素形成的阴离子半径大小顺序是 (用离子符号填).②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是: (用化学式表示).
(2)若甲、乙、丙、丁、戊均为上述①-⑧中的某些元索组成的单质或由其中两种元素组成的化合物,且甲、戊为无色气体,反应a为置换反应,反应b为化合反应.见图1转化关系推测:戊可能为: (列举合适的一例).
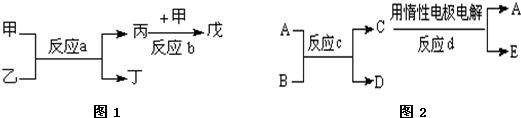
(3)在图2中A、B、C、D、E分别是上述①-⑩中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见金属,D、E分别为无色和黄绿色气体,反应c是用A作电极,在B的水溶液中进行的电解反应,属于置换反应类型.它们的转化关系如图所示.则反应d中阴极的电极反应式为 .
若反应c是在高温下进行的,且用于焊接钢轨,当物质C是一种两性化合物,则反应c的化学方程式 .
(1)若②、⑦、⑧三种元素在周期表中相对位置如下:
| ② | |||
| ⑦ | ⑧ |
(2)若甲、乙、丙、丁、戊均为上述①-⑧中的某些元索组成的单质或由其中两种元素组成的化合物,且甲、戊为无色气体,反应a为置换反应,反应b为化合反应.见图1转化关系推测:戊可能为:

(3)在图2中A、B、C、D、E分别是上述①-⑩中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见金属,D、E分别为无色和黄绿色气体,反应c是用A作电极,在B的水溶液中进行的电解反应,属于置换反应类型.它们的转化关系如图所示.则反应d中阴极的电极反应式为
若反应c是在高温下进行的,且用于焊接钢轨,当物质C是一种两性化合物,则反应c的化学方程式
考点:位置结构性质的相互关系应用,无机物的推断
专题:推断题,元素周期律与元素周期表专题
分析:(1)②形成的化合物种类最多,则②为C元素,②与⑧形成的液体化合物是常见的溶剂,即四氯化碳,那么⑧为Cl,则⑦为S,那么S元素在周期表中的位置即可确定;
(2)C具有还原性,能与金属氧化物发生置换反应生成二氧化碳,二氧化碳与C反应生成CO,据此解答即可;
(3)E为黄绿色气体,黄绿色气体为氯气,那么D为氢气,电解氯化铜溶液可以完成此反应,故阴极为溶液中的铜离子得到电子,发生反应为:Cu2++2e-=Cu;两性化合物为氧化铝,在高温下发生铝热反应,即置换反应,据此解答即可.
(2)C具有还原性,能与金属氧化物发生置换反应生成二氧化碳,二氧化碳与C反应生成CO,据此解答即可;
(3)E为黄绿色气体,黄绿色气体为氯气,那么D为氢气,电解氯化铜溶液可以完成此反应,故阴极为溶液中的铜离子得到电子,发生反应为:Cu2++2e-=Cu;两性化合物为氧化铝,在高温下发生铝热反应,即置换反应,据此解答即可.
解答:
解:(1)②形成的化合物种类最多,则②为C元素,②与⑧形成的液体化合物是常见的溶剂,即四氯化碳,那么⑧为Cl,则⑦为S,那么S元素在周期表中的位置是第三周期ⅥA族;C与Cl形成的化合物为共价化合物;S、Cl两种元素形成的阴离子,最外层电子数相等,Cl的核电荷数比S多,故氯离子的半径小,故半径大小顺序为:S2->Cl-,C、S、Cl三种元素最高价氧化物对应的水化物酸性取决于非金属性强弱,非金属性强,最高价氧化物的酸性强,故:HClO4>H2SO4>H2CO3,
故答案为:第三周期ⅥA族;共价键;S2->Cl-;HClO4>H2SO4>H2CO3;
(2)C具有还原性,能与金属氧化物发生置换反应生成二氧化碳,二氧化碳与C反应生成CO,故答案为:CO;
(3)E为黄绿色气体,黄绿色气体为氯气,那么A为金属铜,电解氯化铜溶液可以完成此反应,故阴极为溶液中的铜离子得到电子,发生反应为:Cu2++2e-=Cu;两性氧化物为氧化铝,能与金属铝能与金属氧化物在高温下发生置换反应,即反应c的化学方程式为:2Al+Fe2O3
Al2O3+2Fe,
故答案为:Cu2++2e-=Cu;2Al+Fe2O3
Al2O3+2Fe.
故答案为:第三周期ⅥA族;共价键;S2->Cl-;HClO4>H2SO4>H2CO3;
(2)C具有还原性,能与金属氧化物发生置换反应生成二氧化碳,二氧化碳与C反应生成CO,故答案为:CO;
(3)E为黄绿色气体,黄绿色气体为氯气,那么A为金属铜,电解氯化铜溶液可以完成此反应,故阴极为溶液中的铜离子得到电子,发生反应为:Cu2++2e-=Cu;两性氧化物为氧化铝,能与金属铝能与金属氧化物在高温下发生置换反应,即反应c的化学方程式为:2Al+Fe2O3
| ||
故答案为:Cu2++2e-=Cu;2Al+Fe2O3
| ||
点评:本题主要考查的是元素的推断以及元素周期律的应用,化学反应类型以及电解方程式的书写等,综合性较强,是一道好题.

练习册系列答案
相关题目
依据热化学方程式得出的结论正确的是( )
| A、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ?mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| B、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ?mol--1,则氢气的燃烧热为241.8 kJ?mol-1 |
| C、已知2C(s)+2O2(g)═2CO2(g)△H=a 2C(s)+O2(g)═2CO(g)△H=b,则a>b |
| D、已知P (白磷,s)=P (红磷,s)△H<0,则白磷比红磷稳定 |
下面是4位同学对“化学与健康”这一话题发表的见解中,正确的是( )
| A、为了减肥,我每天只吃水果、蔬菜 |
| B、食用海产品可防治缺铁性贫血 |
| C、选择食物可调节人体细胞中的酸碱平衡 |
| D、我国应该禁止使用食物防腐剂 |
下列变化中,加入氧化剂可以实现的是( )
| A、Cu2+→Cu |
| B、SO3→SO2 |
| C、NO→NO2 |
| D、Cl2→HCl |
反应NH4HS(s)?NH3(g)+H2S(g)在某温度下达到平衡,下列各种情况中,不会使平衡发生移动的是( )
| A、温度、容积不变时,通入SO2气体 |
| B、移走一部分NH4HS固体 |
| C、容积不变,充入氨气 |
| D、保持压强不变,充入氮气 |
 和一个-Cl,它的可能的结构有几种( )
和一个-Cl,它的可能的结构有几种( )