��Ŀ����
����Ŀ������N2O5Ϊ��������һ�����͵���ɫ�����������ں��ܲ��ϡ�ҽҩ�ȹ�ҵ�еõ��㷺Ӧ�á��ش���������
��1��1840�� Devil�ø��������ͨ����������������õ�N2O5���÷�Ӧ������������һ�����壬�����ʽΪ___________��
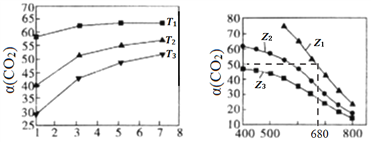
��2��F. Daniels�������ò�ѹ���ڸ��Է�Ӧ�����о���25��ʱN2O5(g)�ֽⷴӦ��
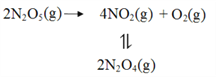
����NO2����ΪN2O4�ķ�Ӧ����Ѹ�ٴﵽƽ�⡣��ϵ����ѹǿp��ʱ��t�ı仯���±���ʾ��t=��ʱ��N2O5(g)��ȫ�ֽ⣩��
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | �� |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
����֪��2N2O5(g)��2N2O4(g)+O2(g) ��H1=4.4 kJ��mol1 ��2NO2(g)��N2O4(g) ��H 2=55.3 kJ��mol1����ӦN2O5(g)��2NO2(g)+1/2O2(g)�Ħ�H =_______ kJ��mol1��
���о�������N2O5(g)�ֽ�ķ�Ӧ����v=2��10-3��P(N2O5)(KPa/min)��t=62 minʱ�������ϵ��P(O2)=2.9 kPa�����ʱ��P(N2O5)=________ kPa��v=_______kPa��min1��
������߷�Ӧ�¶���35�棬��N2O5(g)��ȫ�ֽ����ϵѹǿp��(35��)____63.1 kPa������ڡ������ڡ���С�ڡ�����
��25��ʱN2O4(g)![]() 2NO2(g)��Ӧ��ƽ�ⳣ��Kp=_______kPa��KpΪ�Է�ѹ��ʾ��ƽ�ⳣ��������������1λС������
2NO2(g)��Ӧ��ƽ�ⳣ��Kp=_______kPa��KpΪ�Է�ѹ��ʾ��ƽ�ⳣ��������������1λС������
��3�����ڷ�Ӧ2N2O5(g)��4NO2(g)+O2(g)��R.A.Ogg������·�Ӧ���̣�
��һ�� N2O5![]() NO2+NO3 ����ƽ��
NO2+NO3 ����ƽ��
�ڶ��� NO2+NO3��NO+NO2+O2 ����Ӧ
������ NO+NO3��2NO2 �췴Ӧ
���пɽ�����Ϊ�ڶ�����Ӧ��Ӱ���һ����ƽ�⡣���б�����ȷ����_______������)��
A��v(��һ�����淴Ӧ)��v(�ڶ�����Ӧ) B����Ӧ���м����ֻ��NO3
C���ڶ�����NO2��NO3����ײ��������Ч D����������Ӧ��ܽϸ�
���𰸡�O2 53.1 30.0 6.0��10��2 ���� 13.4 AC
��������
��1������������ԭ��Ӧ���ɣ�������������������Ӧ����N2O5��AgCl��O2��
��2���ٸ��ݸ�˹���ɣ�1/2����-�ڼ�������÷�Ӧ�Ħ�H��
���ں��������У�����ķ�ѹ�����ʵ��������ȣ��ʴ����п��� P��������ʵ���ʹ�ã��ݴ˽�����ؼ��㣻
�۸���pV=nRT�����������У������¶�T����������ѹǿp����
�ܸ�������63.1 kPa ��ֵ��p(O2)=1/2��35.8 kPa ������p(NO2)+ p(N2O4)=(63.1-1/2��35.8)=45.2 kPa�����ݷ�Ӧǰ��ԭ���غ��֪��p(NO2)+ 2p(N2O4)= 35.8 ��2=71.6 kPa �����p(NO2)��p(N2O4)���������Kp��
��3��A��ڶ�����Ӧ������� NO2�� NO3�Ŀ��ټ��٣���˵�һ����Ӧ����ƽ���������淴Ӧ���ʾ��ȵڶ���Ҫ��Ķࣻ
B��������NO3����NO ��
C���Ч��ײ�ǻ���Ӽ�ȡ�����ʱ����ײ�����������е���ײ����Ч��
D����Խ�ͣ���Ӧ����Խ�졣
��1������������ԭ��Ӧ���ɣ���Ӧ����ӦΪN2O5��AgCl��O2��������������ΪO2������������������ǣ�O2��
��2������֪����2N2O5(g)��2N2O4(g)+O2(g) ��H1=4.4 kJ��mol1 ����2NO2(g)��N2O4(g) ��H 2=55.3 kJ��mol1�����ݸ�˹���ɣ�1/2����-��, ��ӦN2O5(g)��2NO2(g)+1/2O2(g)�Ħ�H =1/2��(4.4)+55.3=53.1 kJ��mol1������������������ǣ�53.1��
���ں��������У�����ķ�ѹ�����ʵ��������ȣ��ʴ����п��� P��������ʵ���ʹ����t=62 minʱ��P(O2)=2.9 kPa�����P(N2O5)=��35.8-2��2.9��=30.0 kPa��v=2��10-3��30.0=6.0��10��2 kPa��min1���������������������30.0��6.0��10��2��
�۸���pV=nRT�����������У������¶�T����������ѹǿp����NO2����Ϊ���ȷ�Ӧ���¶���ߣ�ƽ�����ƣ���ϵ���ʵ������ӣ������ѹǿ����63.1 kPa ������������������ǣ����ڡ�
�ܸ�������63.1 kPa ��ֵ��p(O2)=1/2��35.8 kPa ������p(NO2)+ p(N2O4)=(63.1-1/2��35.8)=45.2 kPa�����ݷ�Ӧǰ��ԭ���غ��֪��p(NO2)+2p(N2O4)= 35.8��2=71.6 kPa �����p(NO2)=18.8 kPa, p(N2O4)=26.4kPa��Kp= p2(NO2)/ p(N2O4)= (18.8)2/26.4=13.4 kPa ������������������ǣ�13.4��
��3��A��ɡ�������Ϊ�ڶ�����Ӧ��Ӱ���һ����ƽ�⡱��֪���ڶ�����Ӧ������� NO2�� NO3�Ŀ��ټ��٣���˵�һ����Ӧ����ƽ���������淴Ӧ���ʾ��ȵڶ���Ҫ��Ķ࣬��A����ȷ��
B�����������ʽ��֪���м�������NO3����NO����B�����
C���Ч��ײ�ǻ���Ӽ�ȡ�����ʱ����ײ�����������е���ײ���ﵽ��һҪ����˲��������е���ײ����Ч����C����ȷ��
D����Խ�ͣ���Ӧ����Խ�죬����������Ӧ�ǿ췴Ӧ��˵�����ܽϵͣ���D�����
����������������ȷ��ΪAC��

 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д� Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�����Ŀ��1molij��̬����2mol HCl�ӳɣ���ӳɲ����ֿɱ�8mol Cl2��ȫȡ��������������( )
A.��ϩB.��ȲC.1��3-����ϩD.2-��ϩ
����Ŀ�������뻯ѧ������أ����ж�Ӧϵ�������w.w.w.k.s.5.u.c.o.m
���� | ��Ҫ��ѧ�ɷ� | |
A | �����ʯ | ���������� |
B | ����ʯ��ʯ��ʯ | ̼��� |
C | ��ͨˮ�ࡢ��ͨ���� | ������ |
D | ɳ�ӡ�ʯӢ | �������� |