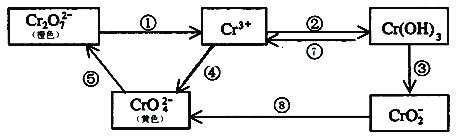
题目内容
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:____,写出④的化学方程式___________________ 。若将C通入酸性高锰酸钾溶液中,溶液褪色,则C表现_______性。在同温同压下,若将C和氯气按体积比为1:1通入品红溶液中,会观察的现象为_______,用离子方程式表示其原因____________________________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,则该反应化学方程式_______________,写出③的化学方程式:__________________。
(3)若A是太阳能电池用的光伏材料,B可用作光导纤维,C、D为钠盐。写出②反应的化学方程式:________________________。C的水溶液俗名为是________,其必须密封保存,其原因为______________________________(用化学方程式表示)。
【答案】杀菌漂白 2SO2+O2![]() 2SO3 还原性 品红不褪色 Cl2+SO2+2H2O =4H++2Cl- +SO42- 4NH3+6NO
2SO3 还原性 品红不褪色 Cl2+SO2+2H2O =4H++2Cl- +SO42- 4NH3+6NO 5N2+6H2O 4NH3+5O2
5N2+6H2O 4NH3+5O2![]() 4NO+6H2O 2NaOH+Si+2H2O=Na2SiO3+2H2↑ 水玻璃 Na2SiO3+H2O+CO2 = H2SiO3 ↓+Na2CO3
4NO+6H2O 2NaOH+Si+2H2O=Na2SiO3+2H2↑ 水玻璃 Na2SiO3+H2O+CO2 = H2SiO3 ↓+Na2CO3
【解析】
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质,则A为S,C为SO2,B为H2S,D为SO3;
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染,判断为NO、NO2,B与C在一定条件下反应生成的A是大气主要成分,推断A为N2,B为NH3,C为NO、D为NO2;
(3)若A是太阳能电池用的光伏材料,B可用于制造光导纤维,则A为Si,B为SiO2,C、D为钠盐,且D是厨房中常用的物质,则C为Na2SiO3、D为Na2CO3。
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质,则A为S,C为SO2,B为H2S,D为SO3,二氧化硫的用途:漂白、杀菌、消毒、作为硫酸的原料等;反应④为二氧化硫与氧气反应生成三氧化硫,反应的化学方程式为2SO2+O2![]() 2SO3;若将C通入酸性高锰酸钾溶液中,二氧化硫被酸性高锰酸钾溶液氧化而使溶液褪色,则C表现还原性;
2SO3;若将C通入酸性高锰酸钾溶液中,二氧化硫被酸性高锰酸钾溶液氧化而使溶液褪色,则C表现还原性;
在同温同压下,若将C和氯气按体积比为1:1通入品红溶液中,会观察的现象为品红不褪色,因两者反应生成硫酸和盐酸,用离子方程式表示其原因为Cl2+SO2+2H2O =4H++2Cl- +SO42-;
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染,判断为NO、NO2,B与C在一定条件下反应生成的A是大气主要成分,推断A为N2,B为NH3,C为NO、D为NO2,B与C在一定条件下反应的化学方程式:4NH3+6NO 5N2+6H2O;反应③是氨气催化氧化生成一氧化氮和水,反应的化学方程式为4NH3+5O2
5N2+6H2O;反应③是氨气催化氧化生成一氧化氮和水,反应的化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)若A是太阳能电池用的光伏材料,B可用于制造光导纤维,则A为Si,B为SiO2,C、D为钠盐,则C为Na2SiO3、D为Na2CO3,反应②为硅与氢氧化钠溶液反应生成硅酸钠和氢气,反应的化学方程式为2NaOH+Si+2H2O=Na2SiO3+2H2↑;C为Na2SiO3,水溶液俗名为是水玻璃;其必须密封保存,否则会被空气中的二氧化碳作用而生成硅酸:Na2SiO3+H2O+CO2 = H2SiO3 ↓+Na2CO3。

【题目】利用下图装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)搅拌棒为何不用铜质的_____________.
(4)实验数据如下表:
①请填写下表中的空白:________。
温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol·L-1NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。依据上表数据计算中和热ΔH=________(取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是______。
A.滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量硫酸溶液的温度计用水洗净后才用来测NaOH溶液的温度
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1 ,2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1,则反应N2O5(g)=2NO2(g)+1/2O2(g)的ΔH =_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率v=2×10-3×P(N2O5)(KPa/min)。t=62 min时,测得体系中P(O2)=2.9 kPa,则此时的P(N2O5)=________ kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”)。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应) B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效 D.第三步反应活化能较高