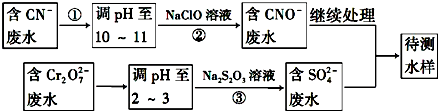
题目内容
6.海带具有富集海水中碘的能力,灼烧后的海带灰中含有碘元素,碘元素以碘离子的形式存在.(1)要从海带灰中获取含碘离子的水溶液,需要的实验操作有①③
①溶解 ②分液 ③过滤 ④萃取
(2)证明溶液中有I-离子的存在,除了使用淀粉溶液外,另一种检验方法是:可向溶液中加入硝酸酸化的硝酸银溶液,现象是黄色沉淀,有关反应的化学方程式为I-+Ag+=AgI↓(设I-离子以KI形式存在).
分析 (1)从海带灰中获取含碘离子的水溶液,应先溶解,然后过滤;
(2)检验碘离子,可加入硝酸酸化的硝酸银溶液,生成AgI沉淀.
解答 解:(1)从海带灰中获取含碘离子的水溶液,应先溶解,然后过滤除去杂质,可得到含碘离子的水溶液,故答案为:①③;
(2)检验碘离子,可加入硝酸酸化的硝酸银溶液,生成AgI黄色沉淀,反应的离子方程式为I-+Ag+=AgI↓,故答案为:硝酸酸化的硝酸银溶液;黄色沉淀;I-+Ag+=AgI↓.
点评 本题考查混合物的分离以及检验,为高频考点,侧重于学生的分析能力的和实验能力的考查,注意把握物质的性质,为解答该题的关键,题目难度不大.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
19.某品牌化妆品的主要成分Z具有美白功效,原从杨树中提取,现可用如图所示反应合成.下列对X、Y、Z的叙述,正确的是( )


| A. | X、Y和Z均能和NaOH溶液反应 | |
| B. | X和Z均能和Na2CO3溶液反应,但不能和NaHCO3溶液反应 | |
| C. | Y既能发生加聚反应,也能发生缩聚反应 | |
| D. | Y分子中所有原子不可能共平面 |
20.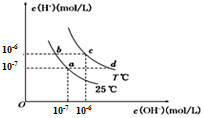 在不同温度下,水溶液中c(H+)与c(OH- )有如图所示关系.下列说法正确的是( )
在不同温度下,水溶液中c(H+)与c(OH- )有如图所示关系.下列说法正确的是( )
 在不同温度下,水溶液中c(H+)与c(OH- )有如图所示关系.下列说法正确的是( )
在不同温度下,水溶液中c(H+)与c(OH- )有如图所示关系.下列说法正确的是( )| A. | c点对应的溶液pH=6,溶液呈弱酸性 | |
| B. | b点对应的溶液中可以大量共存:NH4+、K+、CO32-、Cl- | |
| C. | 若a点表示CH3COOH和CH3COONa的混合溶液,则该溶液中的离子浓度大小为:c(Na+ )>c(CH3COO-)>C(OH- )>c(H + ) | |
| D. | 若d点表示某等浓度、等体积的NH3•H2O和NH4Cl混合溶液,则溶液中的离子浓度存在如下关系:c(NH4+)+2c(H+)═2c(OH-)+c(NH3•H2O) |
1.25℃时,在含有大量的PbI2饱和溶液中存在平衡:PbI2(s)?Pb2+(aq)+2I-(aq),向其中加入KI固体,下列说法正确的是( )
| A. | 溶液中Pb2+和I-浓度都增大 | B. | 溶度积常数Ksp增大 | ||
| C. | 沉淀溶解平衡向逆向移动 | D. | PbI2的溶解度不变 |
11.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的燃烧热(△H)为-192.9kJ•mol-1 | |
| B. | 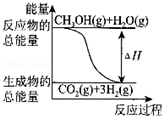 反应①中的能量变化如图所示 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ•mol-1 |
18.设NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 4.6gNO2与N2O4的混合气体中所含氮原子数为0.1NA | |
| B. | 常温常压下1.6g甲烷所含共用电子对数为0.1NA | |
| C. | 标准状况下,6.72LCO2与足量Na2O2反应转移电子数为0.6NA | |
| D. | 50ml 98%浓硫酸(密度为1.84g•cm-3)与足量铜共热,转移的电子数为0.92NA |
15.一定温度下,将 3mol SO2 和 1mol O2 充入一定容密闭容器中,在催化剂存 在下进行下列反应:2SO2(g)+O2(g)?2SO3(g);当达到平衡状态时,下列说法中正确的是( )
| A. | 生成 SO3 为 2 mol | |
| B. | SO2 和 SO3 物质的量之和一定为 3 mol | |
| C. | 1molO2 恰好反应完 | |
| D. | SO2 的物质的量和 SO3 物质的量一定相等 |