题目内容
9.化学小组设计以下实验方案,测定某部分变质为碳酸钠的小苏打样品中NaHCO3的质量分数.(1)方案一:称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量.重复操作,计算.仪器a的名称是坩埚;其中发生反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.实验中为保证NaHCO3分解完全需加热至恒重,判断方法是两次称量的误差不超过0.1g为止.
(2)方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,待沉淀后,过滤,洗涤,干燥,称量固体质量,计算.
写出NaHCO3与足量Ba(OH)2溶液反应的离子方程式HCO3-+OH-+Ba2+=BaCO3↓+H2O;实验中判断沉淀是否完全的方法是取上层清液少许于试管中,加入氢氧化钡溶液,若无沉淀生成,则沉淀完全.过滤操作中,除烧杯、漏斗外,还要用到的玻璃仪器为玻璃棒.
(3)方案三:称取一定质量样品,按如图装置进行实验:
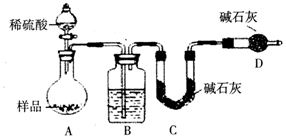
B装置内所盛试剂是浓硫酸;D装置的作用是防止空气中的水蒸气、二氧化碳进入C装置.
实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为70.4%.
某同学认为上述测定结果偏低(填“偏高”或“偏低”),因为实验装置还存在一个明显的缺陷是缺少一套将A、B装置内的CO2气体驱赶到C装置中的装置.
分析 (1)[方案一]固体加热灼烧需要在坩埚中进行,碳酸氢钠不稳定,受热易分解,根据加热前后固体质量变化,根据差量法求碳酸氢钠的质量,进而求得碳酸钠的质量分数;
碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;加热恒重保证碳酸氢钠完全分解;
(2)[方案二]碳酸钠和碳酸氢钠都和氢氧化钡反应生成碳酸钡沉淀,根据生成沉淀的质量来计算碳酸钠的质量分数.
碳酸氢钠和足量氢氧化钡混合反应,碳酸氢钠全部反应,化学式钱系数为1,据此配平书写离子方程式,可取上层清液,继续加沉淀剂,看是否生成沉淀;过滤操作考虑所需仪器;
(3)[方案三]由测定含量的实验可知,A中发生Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,B中为浓硫酸吸收水,干燥二氧化碳,利用C装置吸收二氧化碳,D装置防止空气中的二氧化碳、水进入C装置干扰含量测定,
结合反应定量关系和元素守恒计算得到物质的质量,来计算物质含量;
二氧化碳气体不能全部进入C装置被吸收,需要添加一个装置二氧化碳气体赶入装置C的装置.
解答 解:(1)[方案一]称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量.重复操作,计算.仪器a的名称是坩埚,碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,反应方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,实验中为保证NaHCO3分解完全需加热至恒重判断方法是两次称量的误差不超过0.1g为止,
故答案为:坩埚;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;两次称量的误差不超过0.1g为止;
(2)[方案二]碳酸氢钠和足量氢氧化钡混合反应,碳酸氢钠全部反应,化学式钱系数为1,据此配平书写离子方程式为:HCO3-+OH-+Ba2+=BaCO3↓+H2O,实验中判断沉淀是否完全的方法是:可取上层清液,继续加沉淀剂,看是否生成沉淀,具体操作为:取上层清液少许于试管中,加入氢氧化钡溶液,若无沉淀生成,则沉淀完全,过滤时需用玻璃棒引流,
故答案为:HCO3-+OH-+Ba2+=BaCO3↓+H2O;取上层清液少许于试管中,加入氢氧化钡溶液,若无沉淀生成,则沉淀完全;玻璃棒;
(3)[方案三]B中为浓硫酸吸收水,干燥二氧化碳,空气中的水蒸气和二氧化碳会被碱石灰吸收,故D的作用是吸收空气中的水蒸气和二氧化碳,以确保C装置中质量增加量的准确性,
设Na2CO3和NaHCO3的物质的量分别为x、y,则
Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、
1 1
x x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
2 2
y y
106x+84y=17.90
44x+44y=8.80
解得x=0.05mol
y=0.15mol
则样品中NaHCO3的质量分数为=$\frac{0.15mol×84g/mol}{17.9g}$×100%=70.4%,
实验装置还存在一个明显缺陷为装置中的二氧化碳不能被C全部吸收,导致测定二氧化碳足量减小,计算得到碳酸氢钠的物质的量减小,测定结果偏低,所以需设计一个装置将A、B中的CO2全部吹入C中吸收,
故答案为:浓硫酸;防止空气中的水蒸气、二氧化碳进入C装置;70.4%;偏低;缺少一套将A、B装置内的CO2气体驱赶到C装置中的装置.
点评 本题考查碳酸钠含量的测定实验,为高频考点,把握实验装置的作用及实验目的为解答的关键,侧重分析、计算及实验能力的综合考查,题目难度中等.

①氢解反应:COS(g)+H2(g)═H2S(g)+CO(g)△H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)═H2S(g)+CO2(g)△H2
已知反应中相关的化学键键能数据如下:
| 化学键 | C═O(CO2) | C═O(COS) | C═S | H-S | H-O |
| E(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
(1)在以上脱硫除羰基硫(O═C═S)的反应中,若某反应有4mol电子发生转移,则该反应吸收热量为14kJ,△H2═-35kJ/mol,
(2)CO和H2O(g)能反应生成CO2和H2,写出此反应的热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H═-42kJ/mol.
(3)羰基硫的氢解或水解反应可否设计成原电池否(填“是”或“否”)理由是氢解反应是吸热反应,水解反应是非氧化还原反应.
(4)研究表明,用金属储氢材料(MH)、白金(Pt)、硫酸溶液组成的原电池可以使羰基硫脱硫处理.
①原电池的负极材料是MH(填化学式)
②写出原电池的正极反应式COS+2e-+2H+═CO↑+H2S
③原电池工作时,电流的流动方向是Pt→导线→MH,当电路中有2mol电子流过时能够处理羰基硫(COS)22.4L(标准状况下).
| A. | 干电池 | B. | 铅蓄电池 | C. | 燃料电池 | D. | 锂离子电池 |
| A. | 阴极发生氧化反应,其电极反应式:Ni2++2e-═Ni | |
| B. | 电解后,溶液中存在的金属阳离子只有Ni2+和Zn2+ | |
| C. | 电解后溶液中Ni2+数目减少 | |
| D. | 电解后,电解槽底部的阳极泥中有Pt和Fe |
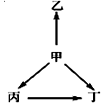 下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )
下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )| 选项 | 甲 | 乙 | 丙 | 丁 | |
| A | S | SO2 | SO3 | H2SO4 | |
| B | N2 | NH3 | NO | NO2 | |
| C | CuO | Cu | Cu(OH)2 | CuCl2 | |
| D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2.82g青蒿素含氧原子数目为0.05NA | |
| B. | 标准状况下,1 mol青蒿素的体积为22.4 L | |
| C. | 青蒿素含氧量为10% | |
| D. | 青蒿素的摩尔质量为282 |
反应时间(t)与容器内气体总压强(p)的数据见表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
(1)欲提高A的平衡转化率,应采取的措施为升高温度、降低压强;(写出两项措施).
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为($\frac{P}{{P}_{0}}$-1)×100%.平衡时A的转化率为94.1%,列式并计算反应的平衡常数K1.5mol/L.
(3)由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=$\frac{0.10P}{{P}_{0}}$ mol,n(A)=0.10×(2-$\frac{P}{P0}$) mol.
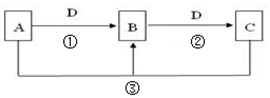 常见无机物A、B、C、D存在如图转化关系:
常见无机物A、B、C、D存在如图转化关系: