题目内容
15.在恒温恒容条件下,能使A(g)+2B(g)?C(g)+D(g)正反应速率增大的措施是( )| A. | 减小C 的浓度 | B. | 通入He气使压强增大 | ||
| C. | 减小B的浓度 | D. | 增大A或B的浓度 |
分析 增大反应物浓度、增大压强、升高温度等均可加快正反应速率,以此来解答.
解答 解:A.减小C 的浓度,正反应速率减小,故A不选;
B.恒容条件下,通入He气使压强增大,反应速率不变,故B不选;
C.减小B的浓度,反应速率减小,故C不选;
D.增大A或B的浓度,正反应速率增大,故D选;
故选D.
点评 本题考查化学反应速率,为高频考点,把握浓度、压强对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的易错点,题目难度不大.

练习册系列答案
相关题目
6.A原子的结构示意图为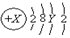 ,则X、Y及该原子3d能级上的电子数不可能的组合是( )
,则X、Y及该原子3d能级上的电子数不可能的组合是( )
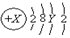 ,则X、Y及该原子3d能级上的电子数不可能的组合是( )
,则X、Y及该原子3d能级上的电子数不可能的组合是( )| A. | 18、8、0 | B. | 20、8、0 | C. | 25、13、5 | D. | 30、18、10 |
6. 室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol•L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol•L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )
 室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol•L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol•L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )| A. | 室温下,0.1 mol•L-1的三种酸溶液中由水电离产生的c(H+)的关系:HA>HB>HD | |
| B. | 滴定至P点时,溶液中c(B-)>c(Na+)>c(H+)>c(HB)>c(OH-) | |
| C. | pH=7 时,三种溶液中:c(A-)=c(B-)=c(D-) | |
| D. | 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+) |
3.阿伏加德罗常数的值为NA.下列说法正确的是( )
| A. | 2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子 | |
| B. | 0.1mol的11B中,含有0.6NA 个中子 | |
| C. | 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA | |
| D. | 常温常压下,17g 羟基含有的电子总数为 7 NA |
10.下列关于现在的长式元素周期表的说法中正确的是( )
| A. | 从左向右数第六纵行是ⅥA族 | |
| B. | 所含元素形成的化合物种类最多的族是第IVA族 | |
| C. | 七个周期18个族 | |
| D. | ⅠA族全部是金属元素 |
20.在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.8mol•L-1.下列判断错误的是( )
| A. | x=4 | |
| B. | 2 min内B的反应速率为0.1 mol•(L•min)-1 | |
| C. | 混合气体密度不变,则表明该反应已达到平衡状态 | |
| D. | B的转化率为40% |
7.下列气体在常温下有颜色的是( )
| A. | HCl | B. | SO2 | C. | NO2 | D. | CO |
4.将16.8LSO2气体(标准状况下)通入1.00L1.00mol•L-1的NaOH溶液中,所得产物中Na2SO3和NaHSO3的物质的量分别为( )
| A. | 0mol,1mol | B. | 0.5mol,0mol | C. | 0.25mol,.0.5mol | D. | 0.25mol,0.25mol |
5.下列能说明氯的非金属性比硫强的事实是( )
①Cl2能与H2S反应生成S ②HClO4酸性比H2SO4强 ③HCl比H2S稳定.
①Cl2能与H2S反应生成S ②HClO4酸性比H2SO4强 ③HCl比H2S稳定.
| A. | ①②③ | B. | ②③ | C. | ①② | D. | ①③ |