题目内容
用CH4催化还原NOx可以消除氮氧化物的污染.例如:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ?mol-1若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移电子总数为 (阿伏加德罗常数的值用NA表示),放出的热量为 kJ.
考点:氧化还原反应的电子转移数目计算
专题:氧化还原反应专题
分析:已知①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ?mol-1,
利用盖斯定律
(①+②)可得:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-
kJ?mol-1=867kJ?mol-1,根据化合价变化计算出反应0.2mol甲烷转移的电子数及放出的热量.
利用盖斯定律
| 1 |
| 2 |
| 574+1160 |
| 2 |
解答:
解:已知①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ?mol-1,
利用盖斯定律
(①+②)可得:③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-
kJ?mol-1=-867kJ?mol-1,
标况下4.48L甲烷的物质的量为:n(CH4)=
=0.2mol,甲烷中碳元素的化合价为-4价,反应产物二氧化碳中C元素化合价为+4价,化合价变化为8,即完全反应1mol甲烷转移了8mol(8NA)电子,
则反应0.2mol甲烷转移的电子总数为:0.2mol×8NA=1.6NA;
根据热化学方程式③可知,完全反应0.2mol甲烷放热的热量为:867kJ?mol-1×0.2mol=173.4kJ,
故答案为:1.6NA;173.4.
利用盖斯定律
| 1 |
| 2 |
| 574+1160 |
| 2 |
标况下4.48L甲烷的物质的量为:n(CH4)=
| 4.48L |
| 22.4L/mol |
则反应0.2mol甲烷转移的电子总数为:0.2mol×8NA=1.6NA;
根据热化学方程式③可知,完全反应0.2mol甲烷放热的热量为:867kJ?mol-1×0.2mol=173.4kJ,
故答案为:1.6NA;173.4.
点评:本题考查反应热以及氧化还原反应的计算,题目难度中等,注意掌握盖斯定律的含义及热化学方程式的书写原则,明确氧化还原反应中电子转移的计算方法,试题侧重于学生的计算能力和分析能力的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将标准状况下的a L NH3(g)溶于0.1L水中,得到的氨水密度为b g?cm-3,则该氨水的物质的量浓度是(水的密度为1g/cm3)( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列物质性质的变化规律与分子间作用力有关的是( )
| A、H2S、HCl的热稳定性依次增强 |
| B、金刚石的熔沸点高于晶体硅 |
| C、NaF、NaCl、NaBr、NaI的熔点依次降低 |
| D、CH4、SiH4、GeH4、SnH4的沸点逐渐升高 |
物质的熔沸点能用键能大小解释的是( )
| A、H2O>H2S |
| B、O2>N2 |
| C、Na>K |
| D、SiO2>CO2 |
日常生活中常用到“加碘食盐”“含氟牙膏”等商品,这里的碘和氟应理解为( )
| A、单质 | B、分子 | C、元素 | D、氧化物 |
下列物质属于纯净物的是( )
| A、空气 | B、干冰 | C、煤 | D、石油 |
一种无色溶液中加入BaCl2溶液,生成不溶于稀HNO3的白色沉淀,则该溶液中含有的离子是( )
A、一定含有SO
| ||
B、一定含有CO
| ||
| C、可能有Ag+ | ||
D、一定有SO
|
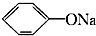 ④CH3COONH4 ⑤NH4HCO3
④CH3COONH4 ⑤NH4HCO3 >HCO3-.常温下,物质的量浓度相同的①、②、③溶液pH由大到小顺序为(填序号)
>HCO3-.常温下,物质的量浓度相同的①、②、③溶液pH由大到小顺序为(填序号)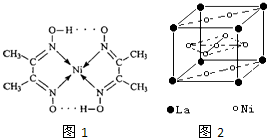 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.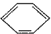 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有