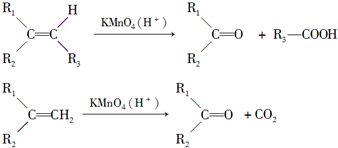
题目内容
18.质量比为16:14的SO2、CO,分子个数之比为1:2;氧原子个数之比为1:1;同温同压下体积比为1:2.分析 先根据n=$\frac{m}{M}$计算出二者的物质的量之比,物质的量与分子、原子个数成正比,结合结合二氧化硫、CO的化学式组成计算出分子个数、氧原子个数之比;根据V=nVm可知同温同压下体积与物质的量成正比,据此计算出二者的体积比.
解答 解:质量比为16:14的SO2、CO,二者的物质的量之比为$\frac{16}{64}$:$\frac{14}{28}$=1:2,物质的量与粒子数成正比,则SO2、CO的分子个数之比为1:2;含有氧原子个数之比为(1×2):(2×1)=1:1;
同温同压下,气体的体积之比等于其物质的量之比,则二者在同温同压下的体积之比为1:2,
故答案为:1:2;1:1;1:2.
点评 本题考查了物质的量的简单计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积、阿伏伽德罗常数之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
8.m mol C2H2跟n mol H2在密闭容器中反应,当该可逆反应达到平衡时,生成p mol C2H4.将反应后的混合气体完全燃烧生成CO2和H2O,所需要氧气的物质的量是( )
| A. | (3m+n)mol | B. | ($\frac{5}{2}$m+$\frac{n}{2}$-3p)mol | C. | (3m+n+2p)mol | D. | ($\frac{5}{2}$m+$\frac{n}{2}$)mol |
6.化学反应前后一定发生变化的是( )
| A. | 原子个数 | B. | 化学键 | C. | 质量 | D. | 元素种类 |
11.下列实验操作与安全事故处理错误的是( )
| A. | 用试管夹从试管底由下往上夹住试管口约$\frac{1}{3}$处,手持试管夹长柄末端,进行加热 | |
| B. | 使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中 | |
| C. | 把玻管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻管插入端,缓慢旋进塞孔中 | |
| D. | 制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中 |
 某同学利用如图装置来验证同主族元素非金属性的变化规律.
某同学利用如图装置来验证同主族元素非金属性的变化规律.