题目内容
8.某溶液只可能含有下列离子中的若干种(不考虑水的电离及离子的水解),Na+、K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,且各种离子的物质的量浓度相等.化学兴趣小组同学欲探究该溶液的组成,进行了如下2个实验:①取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变.
②另取溶液加入BaCl2溶液,有白色沉淀生成.
根据上述实验,以下推测正确的是( )
| A. | 步骤②的白色沉淀可能为BaSO4和BaCO3 | |
| B. | 若该溶液焰色反应呈紫色,则该溶液一定有6种离子组成 | |
| C. | 步骤①中可以确定Fe2+、NO3-的存在,不能确定其它离子的存在 | |
| D. | 溶液中难以确定Al3+的存在与否 |
分析 取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,则说明含有具有氧化性的NO3-和还原性的Fe2+,此时溶液依然澄清,且溶液中阴离子种类不变,故无CO32-,;若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有CO32-或SO42-,因为有Fe2+所以没有CO32-;结合溶液中的电荷守恒分析.
解答 解:另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,则说明含有具有氧化性的NO3-和还原性的Fe2+;
若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有CO32-或SO42-,因为有Fe2+,Fe2+与CO32-不能共存,所以没有CO32-;则溶液中的离子有Fe2+、NO3-、SO42-,已知各种离子的物质的量浓度相等,阴离子电荷比阳离子电荷多,所以还有另外的阳离子,
A、Fe2+与CO32-不能共存,所以没有CO32-,故沉淀没有BaCO3,故A错误;
B、若该溶液焰色反应呈紫色,则有K+,上述分析有NO3-、Fe2+、SO42-,各种离子的物质的量浓度相等,此时电荷已经守恒,故B错误;
C、步骤①中可以确定Fe2+、NO3-的存在,有二价铁则无碳酸根,两者不能共存,且溶液中阴离子种类不变,故C错误;
D、根据B的分子,铝离子是否存在取决于阴离子中是否还有氯离子,而题目中没有信息能证明氯离子的村子与否,故D正确.
故选D.
点评 本题考查了离子检验的实验方法和反应现象分析,掌握离子性质和溶液中电荷守恒计算判断存在的离子是解题关键,题目难度较大.

练习册系列答案
相关题目
8.化学与生活紧密联系,下列有关物质的用途正确的是( )
| A. | Fe3O4俗称铁红,常做红色油漆和涂料 | |
| B. | 硫酸铝和碳酸钠的混合物可用作泡沫灭火器 | |
| C. | 氢氧化铝、氢氧化钠、碳酸钠都是常见的胃酸中和剂 | |
| D. | 利用农作物秸秆制取乙醇 |
16.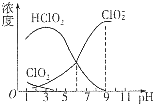 亚氯酸钠(NaClO2)是一种高效漂白剂.在NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列说法错误的是( )
亚氯酸钠(NaClO2)是一种高效漂白剂.在NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列说法错误的是( )
 亚氯酸钠(NaClO2)是一种高效漂白剂.在NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列说法错误的是( )
亚氯酸钠(NaClO2)是一种高效漂白剂.在NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列说法错误的是( )| A. | 亚氯酸钠溶液在碱性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数值Ka=10-6 | |
| C. | 使用该漂白剂的最佳pH约为4 | |
| D. | 25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合(pH=5.1),则混合溶液中有c(HClO2)+c(H+)=c(ClO${\;}_{2}^{-}$)+c(OH-) |
3.下列说法不正确的是( )
| A. | 硝化甘油在体内能够分解出NO,少量的NO会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛 | |
| B. | 侯氏制碱法的工艺流程应用了物质溶解度的差异 | |
| C. | 刚玉、红宝石、蓝宝石的主要成分是氧化铝,而青花瓷、石英玻璃、分子筛的主要成分是硅酸盐 | |
| D. | 生物炼铜法就是利用某种能耐受铜盐毒性的细菌,利用空气中的氧气把不溶性的硫化铜转化为可溶性的铜盐,从而使铜的冶炼变得成本低,污染小,反应条件十分简单 |
13.如图装置进行相关实验能实现目的是( )
| I中试剂 | II中试剂 | 目的 | 装置 | |
| A | 澄清石灰水 | 足量酸性KMnO4溶液 | 检验SO2中是否混合有CO2 | 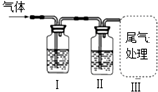 |
| B | 溴水 | NaOH溶液 | 除去CH4中混有的C2H4气体 | |
| C | 饱和Na2CO3溶液 | 浓硫酸 | 除去CO2中混有HCl气体 | |
| D | 澄清石灰水 | CuSO4溶液 | 证明混合气体中含有CO2和H2O气体. |
| A. | A | B. | B | C. | C | D. | D |
20.下列说法正确的是( )
| A. | 在H+的作用下,溶液中黄色的CrO42-能被氧化为橙红色的Cr2O72- | |
| B. | 7.8 gNa2O2完全反应一定转移了0.1mol电子 | |
| C. | 只用溴水可鉴别出苯、四氯化碳、乙醇、乙醛、环己烯五种无色液体 | |
| D. | 常温下,NH4Cl和NH3•H2O混合的溶液pH一定大于7 |
18.下列反应的离子方程式正确的是( )
| A. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | AgCl溶于氨水:AgCl+2NH3•H2O=[Ag(NH3)2]++Clˉ+2H2O | |
| C. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO3 2- | |
| D. | 用稀硝酸除去试管内壁银:Ag+2H++NO3-=Ag++NO2↑+H2O |
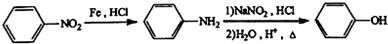
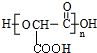 +(n-1)H2O.
+(n-1)H2O.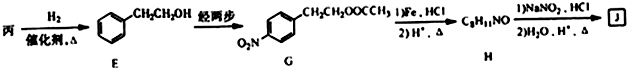
 (标明配位键);其中Al的杂化方式是sp3.(相对原子质量:Al-27;Cl-35.5)
(标明配位键);其中Al的杂化方式是sp3.(相对原子质量:Al-27;Cl-35.5)