题目内容
7.分别将下列各组物质同时加到水中,得到无色透明溶液的是( )| A. | FeCl3 NaOH KCl | B. | KCl Na2CO3 Na2SO4 | ||
| C. | BaCl2 NaCl Na2SO4 | D. | NaCl AgNO3 KCl |
分析 得到无色、透明溶液,要注意能否反应生成沉淀及常见离子在水溶液中的颜色,以此解答该题.
解答 解:A.FeCl3、NaOH、KCl溶于水会生成红褐色的氢氧化铁沉淀,故A错误;
B.KCl、Na2CO3、Na2SO4溶于水不反应,且都是无色的,故B正确;
C.BaCl2、Na2SO4反应生成硫酸钡沉淀,故C错误;
D.NaCl、AgNO3、KCl反应生成氯化银沉淀,故D错误.
故选B.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,学生熟悉复分解反应发生的条件及物质的溶解性是解答的关键,并熟悉常见物质在水中的颜色,难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
18.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为H2(g)和Cl2(g)反应生成HCl (g)过程中的能量变化:
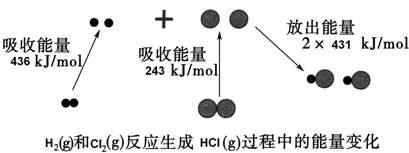
下列说法中正确的是( )

下列说法中正确的是( )
| A. | 1 mol H2(g)和1 mol Cl2(g)具有的总能量大于2 mol HCl(g)具有的总能量 | |
| B. | 该反应的△H>0 | |
| C. | 通常情况下,H2(g)和Cl2(g)混合容易直接生成HCl(g) | |
| D. | 生成的HCl溶于水会发生电离,即HCl=H++Cl-,由此判断,HCl中存在离子键 |
18.将0.2molMnO2和50mL12mol•L-1的盐酸混合后加热,待反应完全后,向反应后的溶液中加入足量AgNO3溶液,生成AgCl沉淀的物质的量为(盐酸的挥发忽略不计)( )
| A. | 等于0.3mol | B. | 大于0.3mol | ||
| C. | 大于0.3mol,小于0.6mol | D. | 等于0.6mol |
15.下列离子方程式的书写正确的是( )
| A. | 铜和稀硫酸反应:Cu+2H+=Cu2++H2↑ | |
| B. | NaHCO3溶液与HCl溶液反应:H++HCO3-=CO2↑+H2O | |
| C. | 铝和硫酸铜溶液的反应Al+Cu2+=Al3++Cu | |
| D. | 氯化铁滴入沸水中生成氢氧化铁胶体Fe3++3H2O=Fe(OH)3↓+3H+ |
12.有A、B、C、D四种金属,进行如下实验:①将A与B浸在稀硫酸中用导线相连,A逐渐溶解,B上有气泡逸出;②将A、D分别投入等浓度盐酸中,D比A反应剧烈.③将B浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
| A. | D>C>A>B | B. | D>A>B>C | C. | D>B>A>C | D. | B>A>D>C |
16.0.1mol•L-1盐酸分别跟20mL NaOH和20 mL NH3•H2O反应,都消耗了20mL盐酸,这表明NaOH溶液和氨水的关系( )
| A. | 物质的量浓度相同 | B. | 氢氧根离子浓度相同 | ||
| C. | pH相同 | D. | 溶液中离子浓度相同 |