题目内容
9.实验室用20gNaOH配制成500mL溶液.(1)该NaOH溶液的物质的量浓度是1mol?L-1;
(2)从中取出1mL,其物质的量浓度是1mol?L-1,含NaOH的质量是0.04g;
(3)若将这1mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度是0.01mol?L-1,含NaOH的质量是0.04g.
分析 (1)根据n=$\frac{\frac{m}{M}}{V}$计算出所得溶液的物质的量浓度;
(2)溶液具有均一性,取出溶液的浓度不变,根据m=cVM计算出需要氢氧化钠的质量;
(3)稀释过程中氢氧化钠的物质的量不变,根据c=$\frac{n}{V}$计算出稀释后氢氧化钠的浓度,稀释过程中氢氧化钠的质量不变.
解答 解:(1)实验室用20gNaOH配制成500mL溶液,所得溶液的浓度为:$\frac{\frac{20g}{40g/mol}}{0.5L}$=1 mol?L-1,
故答案为:1 mol?L-1;
(2)从中取出1mL,其物质的量浓度不变,仍然为1mol/L,取出溶液中含有氢氧化钠的质量为:40g/mol×1mol/L×0.001L=0.04g,
故答案为:1 mol?L-1;0.04 g;
(3)若将这1mL溶液用水稀释到100mL,稀释过程中溶质的物质的量不变,所得溶液中溶质的物质的量浓度是:$\frac{1mol/L×0.001L}{0.1L}$=0.01 mol?L-1;稀释过程中氢氧化钠的质量不变,含NaOH的质量仍然为0.04g,
故答案为:0.01 mol?L-1;0.04 g.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意掌握物质的量与摩尔质量、物质的量浓度之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
19.已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为( )
| A. | 436 kJ | B. | 557 kJ | C. | 920 kJ | D. | 618 kJ |
20.关于电解质的说法正确的是( )
| A. | 电解质一定是化合物 | B. | 电解质可以是混合物 | ||
| C. | 电解质不一定是化合物 | D. | 电解质一定是单质 |
17.现有失去标签的氯化钙、硝酸银、盐酸、碳酸钠四种无色溶液,为了测定四种溶液各是什么,将它们随意编号为A、B、C、D后,按表进行实验.将产生的现象记录如表:
根据实验现象按要求回答:
(1)A、B、C、D溶液中溶质的化学式:ACaCl2;BHCl;CAgNO3;DNa2CO3.
(2)写出实验顺序中发生反应的②③④中有关的离子方程式:②CO32-+2H+=CO2↑+H2O;③Cl-+Ag+=AgCl↓;④CO32-+Ca2+=CaCO3↓.
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 没有明显变化 |
| ② | B+D | 有无色、无味气体生成 |
| ③ | B+C | 有白色沉淀生成 |
| ④ | A+D | 有白色沉淀生成 |
(1)A、B、C、D溶液中溶质的化学式:ACaCl2;BHCl;CAgNO3;DNa2CO3.
(2)写出实验顺序中发生反应的②③④中有关的离子方程式:②CO32-+2H+=CO2↑+H2O;③Cl-+Ag+=AgCl↓;④CO32-+Ca2+=CaCO3↓.
1.下列是我们日常生活中接触到的物质,其中属于纯净物的是( )
| A. | 蒸馏水 | B. | 可口可乐 | C. | 食醋 | D. | 洁净的空气 |
18.反应X(g)+Y(g)?2Z(g)△H<0,达到平衡时,下列说法正确的是( )
| A. | 增大压强,平衡向右移动 | B. | 加入催化剂,Z的产率增大 | ||
| C. | 增大c(X),X的转化率增大 | D. | 降低温度,Y的转化率增大 |
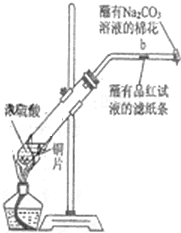 如图所示,将6.4g铜与12mL18mol•L-1浓硫酸在试管a中共热.据此回答:
如图所示,将6.4g铜与12mL18mol•L-1浓硫酸在试管a中共热.据此回答: