题目内容
4.下列说法中不正确的是( )| A. | 维勒用无机物合成了尿素,突破了无机物与有机物的界限 | |
| B. | 尼龙、棉花、天然橡胶、ABS树脂都是由高分子化合物组成的物质 | |
| C. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| D. | 开发核能、太阳能等新能源,推广乙醇汽油,使用无磷洗涤剂都可直接降低碳排放量 |
分析 A、1828年德国化学家维勒,将一种无机物NH4CNO的水溶液加热得到了有机物尿素;
B、相对分子质量在10000以上的有机化合物为高分子化合物;
C、红外光谱仪用于测定有机物的官能团;核磁共振仪用于测定有机物分子中氢原子的种类和数目;质谱法用于测定有机物的相对分子质量;
D、使用无磷洗涤剂,可减少水华、赤潮等污染.
解答 解:A、维勒用无机物NH4CNO合成了有机物尿素,突破了无机物与有机物的界限,故A正确;
B、尼龙、棉花、天然橡胶、ABS树脂相对分子质量在10000以上,都是由高分子化合物组成的物质,故B正确;
C、红外光谱仪用于测定有机物的官能团,核磁共振仪用于测定有机物分子中氢原子的种类和数目,质谱法用于测定有机物的相对分子质量,所以三者都可用于有机化合物结构的分析,故C正确;
D、使用无磷洗涤剂,可减少水华、赤潮等污染,不可降低碳排放量,故D错误;
故选:D.
点评 本题主要考查了化学史、有机物分子结构的方法、环境污染、高分子化合物等知识,注意对应知识的掌握.

练习册系列答案
相关题目
12.下列物质中含有极性共价键的是( )
| A. | 氢气 | B. | 氮气 | C. | 氧气 | D. | 氨气 |
19.电解水时,可以加入少量电解质以增强导电性,下列物质中不宜加入的是( )
| A. | Na2SO4 | B. | NaOH | C. | HCl | D. | H2SO4 |
9.下列有关有机化合物的认识正确的是( )
| A. | 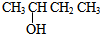 的名称为2-羟基丁烷 的名称为2-羟基丁烷 | |
| B. | 乙酸、乙酸乙酯和淀粉的最简式均为CH2O | |
| C. | (CH3)3CCH2C(CH3)=CH2的名称为 2,2,4-三甲基-1-戊烯 | |
| D. | 按系统命名法CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
16.下列说法正确的是( )
| A. | 除去溴苯中的溴,可加入过量的KI溶液后分液 | |
| B. | 葡萄糖、蔗糖都能与新制氢氧化铜浊液发生反应 | |
| C. | 蛋白质水解的最终产物既能和强酸反应,又能和强碱反应 | |
| D. | 纤维素属于高分子化合物,与淀粉互为同分异构体 |
1.实验室从海带灰中提取碘的操作过程中,仪器选用不正确的是( )
| A. | 称取5 g左右的干海带--托盘天平 | |
| B. | 灼烧干海带至完全变成灰烬--坩埚 | |
| C. | 过滤煮沸后的海带灰和水的混合物--漏斗 | |
| D. | 用四氯化碳从氧化后的海带灰浸取液中提取碘--长颈漏斗 |
2. 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(2)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
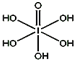
(3)已知高碘酸有两种形式,化学式分别为H5IO6(结构如上图)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-.I3-离子的中心原子周围σ键电子对对数为2.与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(5)已知CaF2晶体的密度为ρg/cm3,NA为阿伏加德罗常数,CaF2晶胞的边长为a pm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}×ρ×1{0}^{-30}×{N}_{A}}{4}$(用含a的式子表示).
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.(1)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的.使氢氟酸分子缔合的作用力是氢键.
(2)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-.I3-离子的中心原子周围σ键电子对对数为2.与KI3类似的,还有CsICl2等.已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列A式发生.
A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(5)已知CaF2晶体的密度为ρg/cm3,NA为阿伏加德罗常数,CaF2晶胞的边长为a pm,则CaF2的相对分子质量可以表示为$\frac{{a}^{3}×ρ×1{0}^{-30}×{N}_{A}}{4}$(用含a的式子表示).
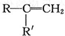 $→_{②酸化}^{①KMnO_{4}/OH-}$
$→_{②酸化}^{①KMnO_{4}/OH-}$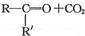 (R、R′可表示烃基或官能团)A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
(R、R′可表示烃基或官能团)A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
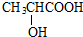 $→_{△}^{浓硫酸}$CH2=CHCOOH+H2O,其反应类型是消去反应.
$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O,其反应类型是消去反应.