题目内容
室温下,某溶液中由水电离产生c(H+)=10-13 mol.L-1,该溶液的溶质不可能是( )
| A、NaHSO4 |
| B、NaCl |
| C、HCl |
| D、Ba(OH)2 |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:常温下,水的离子积为1×10-14,由水电离产生的c(H+)等于10-10mol/L,说明该溶液中的溶质抑制了水的电离,该溶液为酸性或者碱性溶液,据此进行判断.
解答:
解:由水电离产生的c(H+)等于10-13mol/L,说明溶液中的溶质抑制了水的电离,Ba(OH)2、HCl、NaHSO4都能电离出氢氧根离子或氢离子,抑制水的电离;而NaCl中的钠离子和氯离子对水的电离无影响,故该溶液的溶质不可能是NaCl,
故选B.
故选B.
点评:本题考查水的电离及其影响因素,难度不大,注意酸碱溶液抑制水的电离,含有弱酸根或弱碱根离子的盐溶液促进水的电离.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
把下列四种X溶液分别加入四个盛有10mL2mol?L-1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸发生反应,其中反应速率最快的是( )
| A、10℃20mL3mol?L-1的X溶液 |
| B、20℃30mL2mol?L-1的X溶液 |
| C、20℃10mL4mol?L-1的X溶液 |
| D、10℃10mL2mol?L-1的X溶液 |
将20g由Mg、Zn、Fe组成的混合物与40mL稀硫酸恰好完全反应,产生的氢气在标准状况下为11.2L,则三种金属的物质的量之和为( )
| A、1.0mol |
| B、0.5mol |
| C、0.25mol |
| D、0.125mol |
下列各有机物的命名正确的是( )
A、 二溴乙烷 二溴乙烷 |
B、 1,3-二甲苯 1,3-二甲苯 |
C、 乙基丁烷 乙基丁烷 |
| D、CH2=CH-CH=CH21,3一二丁稀 |
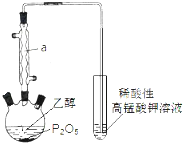 已知用P2O5作催化剂,加热乙醇可制备乙烯,反应温度为80℃~210℃.某研究性小组设计了如下的装置制备并检验产生的乙烯气体(夹持和加热仪器略去).
已知用P2O5作催化剂,加热乙醇可制备乙烯,反应温度为80℃~210℃.某研究性小组设计了如下的装置制备并检验产生的乙烯气体(夹持和加热仪器略去). )
)