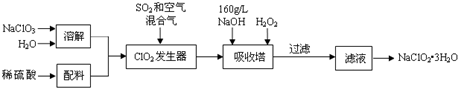
题目内容
4.某化合物丙是药物中间体,其合成路线如下: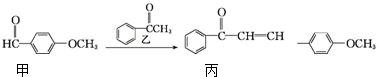
下列有关叙述不正确的是( )
| A. | 丙的分子式为C16H14O2 | |
| B. | 丙分子中所有碳原子可能共平面 | |
| C. | 用酸性KMnO4溶液可区分甲和丙 | |
| D. | 乙在一定条件下最多与4mol氢气发生加成反应 |
分析 A.根据结构简式确定元素种类和原子个数,可确定分子式;
B.根据苯环和碳碳双键的结构特点判断;
C.甲含有醛基,丙含有碳碳双键,都可被酸性高锰酸钾氧化;
D.乙中苯环和羰基都可与氢气发生加成反应.
解答 解:A.由结构简式可知丙的分子式为C16H14O2,故A正确;
B.丙含有苯环和碳碳双键都为平面形结构,与苯环和碳碳双键直接相连的原子可能在同一个平面上,故B正确;
C.甲含有醛基,丙含有碳碳双键,都可被酸性高锰酸钾氧化,不能用高锰酸钾区分,故C错误;
D.乙中苯环和羰基都可与氢气发生加成反应,则乙在一定条件下最多与4mol氢气发生加成反应,故D正确.
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
5.在2A+B?3C+5D反应中,表示该反应速率最快的是( )
| A. | v(A)=0.5 mol/(L•s) | B. | v(B)=0.3 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=60 mol/(L•min) |
19.下列表示物质的图或式正确的是( )
| A. | 氮气的电子式 | B. | Mg2+的结构示意图 | ||
| C. | NH3的结构式  | D. | O22-的电子式为: |
16.2009年诺贝尔物理奖授予了“光导纤维之父”高锟.光导纤维的成分是( )
| A. | Si | B. | 石墨 | C. | SiO2 | D. | 纳米硅 |
14.下列说法正确的是( )
| A. | 22.4升氧气中一定含有阿伏加德罗常数个氧分子 | |
| B. | 1摩氧气的质量是32克 | |
| C. | 1摩氧气与1摩二氧化碳中的原子个数相等 | |
| D. | H2SO4的摩尔质量是98克 |
 A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:
A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空: