题目内容
12. A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:
A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:(1)A、B、C的第一电离能由小到大的顺序为C<O<N.
(2)A的最高价氧化物对应的水化物分子中其中心原子采取sp2杂化.
(3)与A、B形成的阴离子(AB-)互为等电子体的分子有N2、CO.
(4)基态D原子的核外电子排布式为1s22s22p63s23p63d104s1,图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比为1:5.
(5)向D的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液.写出此蓝色沉淀溶解的离子方程式:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
分析 A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大,B原子的最外层p轨道的电子为半满结构,最外层电子排布为2s22p3,故B为N元素,第2周期元素A原子的核外成对电子数是未成对电子数的2倍,故原子核外电子排布为1s22s1或1s22s22p2,结合(3)能与N元素形成阴离子(AN-),故A为C元素,C是地壳中含量最高的元素,所以C是O元素,D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,故D元素原子各层电子数分别为2、8、18、1,是29号Cu元素,据此解答.
解答 解:A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大,B原子的最外层p轨道的电子为半满结构,最外层电子排布为2s22p3,故B为N元素,第2周期元素A原子的核外成对电子数是未成对电子数的2倍,故原子核外电子排布为1s22s1或1s22s22p2,结合(3)能与N元素形成阴离子(AN-),故A为C元素,C是地壳中含量最高的元素,所以C是O元素,D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,故D元素原子各层电子数分别为2、8、18、1,是29号Cu元素,
(1)C、N、S元素是同一周期元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N,
故答案为:C<O<N;
(2)H2CO3中C原子最外层电子数全部成键,没有孤电子对,成1个C=O双键,2个C-O单键,杂化轨道数目为3,采取sp2杂化,
故答案为:sp2;
(3)将CN-中C原子及1个负电荷换成1个N原子,可得的等电子体N2,将N原子及1个负电荷换成1个O原子,可得的等电子体CO,
故答案为:N2、CO;
(4)D的原子序数是29,为Cu元素,其原子核外电子排布式为:1s22s22p63s23p63d104s1,
由晶胞结构可知,Ca原子处于顶点,晶胞中含有Ca原子数目为8×$\frac{1}{8}$=1,Cu原子处于晶胞内部与面上、面心,晶胞中Cu数目为1+4×$\frac{1}{2}$+4×$\frac{1}{2}$=5,故该合金中Ca和Cu的原子个数比为1:5,
故答案为:1s22s22p63s23p63d104s1;1:5;
(5)将氨水滴加到硫酸铜溶液中,首先反应生成氢氧化铜沉淀,继续滴加氨水,氢氧化铜与氨水反应生成四氨合铜络离子,反应的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
点评 本题以元素的推断考查了原子的杂化方式、核外电子排布规律、电离能、晶胞计算、配合物等知识点,注意同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA和第IIIA族、第VA族和第VIA族之间异常,为易错点.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 等量H2在O2中完全燃烧,生成H2O(g)与生成H2O(l)放出的能量相同 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H是相同的 |
| A. | NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-) | |
| B. | 0.1mol/L醋酸钠溶液20ml与0.1mol/L盐酸10ml混合后的溶液中:c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 物质的量浓度相等的①NH4Cl、②(NH4)2SO4、③NH4Al(SO4)2三种溶液中,c(NH4+)由大到小的顺序为:③>②>① | |
| D. | 浓度为0.1mol/L的①氨水、②C6H5ONa溶液、③Na2CO3溶液、④NaHCO3溶液,pH的大小顺序:①>④>③>② |
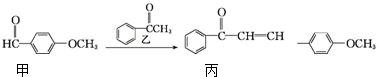
下列有关叙述不正确的是( )
| A. | 丙的分子式为C16H14O2 | |
| B. | 丙分子中所有碳原子可能共平面 | |
| C. | 用酸性KMnO4溶液可区分甲和丙 | |
| D. | 乙在一定条件下最多与4mol氢气发生加成反应 |
| A. | FeCl3 | B. | NaHCO3 | C. | MgSO4 | D. | Na2SO3 |

