题目内容
回答下列氯气的相关问题:
(1)将紫色石蕊试液滴入新制的氯水,现象是 ,起作用的微粒是 .
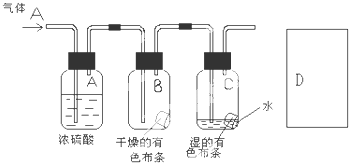
(2)某生应用下图所示方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题:
①该项研究(实验)的主要目的是
②浓硫酸的作用是 .与研究目的直接相关的实验现象是
③从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是 .请在图D处以图的形式表明克服事故隐患的措施,写出化学方程式 .
(3)漂白粉是用Cl2与石灰乳反应来制取的,制取反应的化学方程式为 .漂白粉在空气中保存不当能失效,请用方程式表示原理 、 .
(1)将紫色石蕊试液滴入新制的氯水,现象是
(2)某生应用下图所示方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题:
①该项研究(实验)的主要目的是
②浓硫酸的作用是
③从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是
(3)漂白粉是用Cl2与石灰乳反应来制取的,制取反应的化学方程式为

考点:探究氯水、氯气的漂白作用,氯气的化学性质
专题:
分析:本实验的目的是探究氯气具有漂白性的条件下,干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,氯气有毒,应进行尾气处理,不能随意排放到空气中,一般用NaOH溶液吸收氯气.
解答:
解:(1)新制的氯水中含HCl、HClO,则石蕊试液滴加到新制的氯水中,石蕊遇酸变红色,然后被HClO漂白,则观察到褪色,即溶液先变红后褪色,故答案为:溶液先变红后褪色;HCl和HClO;
(2)①本实验为对比实验,将氯气分别于干燥布条和湿润布条进行比较,不难看出实验目的是探究氯气具有漂白性的条件,故答案为:探究氯气具有漂白性的条件;
②浓硫酸具有吸水性,常用作干燥剂,本试验中起到吸收气体C中的水的作用,燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,
故答案为:吸收气体A中的水;B干燥布条不褪色,C湿润的布条褪色;
③氯气有毒,应进行尾气处理,不能随意排放到空气中,一般用NaOH溶液吸收多余的氯气,其反应的方程式为:Cl2+2NaOH=NaClO+NaCl+H2O,氯气有毒,应进行尾气处理,不能随意排放到空气中,应加尾气处理装置,如图 ,
,
故答案为:没有尾气处理装置,造成环境污染;Cl2+2NaOH=NaClO+NaCl+H2O; ;
;
(3)以氯气和石灰乳为原料制造漂白粉,反应生成CaCl2、Ca(ClO)2、H2O,该反应为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
漂白粉久置空气中,与水、二氧化碳反应生成碳酸钙和次氯酸,次氯酸分解而使其漂白失效,发生的反应为CO2+Ca(ClO)2+H2O=CaCO3+2HClO、2HClO
2HCl+O2↑,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;CO2+Ca(ClO)2+H2O=CaCO3+2HClO;2HClO
2HCl+O2↑.
(2)①本实验为对比实验,将氯气分别于干燥布条和湿润布条进行比较,不难看出实验目的是探究氯气具有漂白性的条件,故答案为:探究氯气具有漂白性的条件;
②浓硫酸具有吸水性,常用作干燥剂,本试验中起到吸收气体C中的水的作用,燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,
故答案为:吸收气体A中的水;B干燥布条不褪色,C湿润的布条褪色;
③氯气有毒,应进行尾气处理,不能随意排放到空气中,一般用NaOH溶液吸收多余的氯气,其反应的方程式为:Cl2+2NaOH=NaClO+NaCl+H2O,氯气有毒,应进行尾气处理,不能随意排放到空气中,应加尾气处理装置,如图
 ,
,故答案为:没有尾气处理装置,造成环境污染;Cl2+2NaOH=NaClO+NaCl+H2O;
 ;
;(3)以氯气和石灰乳为原料制造漂白粉,反应生成CaCl2、Ca(ClO)2、H2O,该反应为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
漂白粉久置空气中,与水、二氧化碳反应生成碳酸钙和次氯酸,次氯酸分解而使其漂白失效,发生的反应为CO2+Ca(ClO)2+H2O=CaCO3+2HClO、2HClO
| ||
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;CO2+Ca(ClO)2+H2O=CaCO3+2HClO;2HClO
| ||
点评:本题考查氯气的漂白性的探究实验,注意氯气与氯水性质的区别以及漂白粉变质的化学反应,把握强酸制取弱酸的反应原理及HClO的不稳定性为解答的关键,注意反应方程式的书写,题目难度不大.

练习册系列答案
相关题目
 目前已研制出一种用磺酸类质子作溶剂的酸 性乙醇电池,其效率比甲醇电池高出32倍,电池构造如图所示,电池反应式为:C2H5OH+3O2=2CO2+3H2O.下列关于该电池的说法正确的是( )
目前已研制出一种用磺酸类质子作溶剂的酸 性乙醇电池,其效率比甲醇电池高出32倍,电池构造如图所示,电池反应式为:C2H5OH+3O2=2CO2+3H2O.下列关于该电池的说法正确的是( )| A、通入乙醇的电极为该电池的正极 |
| B、放电过程中,电源内部的H+从正极区向负极区迁移 |
| C、该电池的正极反应为:4H++O2+4e-=2H2O |
| D、用该电池做电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2 mol C2H5OH,阴极产生标准状况下气体的体积为13.44 L |
氯化铁溶液与氢氧化铁胶体具有的共同性质是( )
| A、分散质粒子直径在1~100nm之间 |
| B、能透过半透膜 |
| C、呈红褐色 |
| D、都是透明的 |
对下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A、0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(OH-)>c(H+) |
| B、0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) |
| C、将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D、在25℃100 mL NH4Cl溶液中:c(H+)=c(NH3?H2O)+c(OH-) |
已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):这五种化合物中Cl元素化合价由低到高的顺序是( )
①G-→Q+NaCl
②Q+H2O
X+H2
③Y+NaOH-→G+Q+H2O
④Z+NaOH-→Q+X+H2O.
①G-→Q+NaCl
②Q+H2O
| 电解 |
③Y+NaOH-→G+Q+H2O
④Z+NaOH-→Q+X+H2O.
| A、G、Y、Q、Z、X |
| B、X、Z、Q、G、Y |
| C、X、Z、Q、Y、G |
| D、G、Q、Y、Z、X |
 把一小块镁铝金溶于100mL盐酸中,然后向其中滴入1mol?L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.
把一小块镁铝金溶于100mL盐酸中,然后向其中滴入1mol?L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示. 将m g由NaOH、MgCl2、AlCl3三种固体组成的混合物投入足量水中,得到一悬浊液,将该悬浊液分为两等份:一份经过滤、洗涤、干燥得1.16g白色沉淀,在另一份悬浊液中逐滴加入1mol?L-1的HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示.
将m g由NaOH、MgCl2、AlCl3三种固体组成的混合物投入足量水中,得到一悬浊液,将该悬浊液分为两等份:一份经过滤、洗涤、干燥得1.16g白色沉淀,在另一份悬浊液中逐滴加入1mol?L-1的HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示.