题目内容
下列反应中属于氧化还原反应的是( )
| A、NaClO+CH3COOH═CH3COONa+HClO | ||||
B、Cu2(OH)2CO3
| ||||
| C、2NO2+2NaOH═NaNO3+NaNO2+H2O | ||||
| D、3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl |
考点:氧化还原反应
专题:
分析:属于氧化还原反应,说明该反应中有电子转移,其特征是有元素化合价升降,据此分析解答.
解答:
解:A.NaClO+CH3COOH═CH3COONa+HClO中各元素化合价不变,所以不属于氧化还原反应,故A错误;
B.Cu2(OH)2CO3
2CuO+H2O+CO2↑中各元素化合价不变,所以不属于氧化还原反应,故B错误;
C.2NO2+2NaOH═NaNO3+NaNO2+H2O 中N元素化合价发生变化,属于氧化还原反应,故C正确;
D.3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl中各元素化合价不变,所以不属于氧化还原反应,故D错误;
故选C.
B.Cu2(OH)2CO3
| ||
C.2NO2+2NaOH═NaNO3+NaNO2+H2O 中N元素化合价发生变化,属于氧化还原反应,故C正确;
D.3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl中各元素化合价不变,所以不属于氧化还原反应,故D错误;
故选C.
点评:本题考查了氧化还原反应判断,根据元素化合价变化来分析解答即可,知道常见元素化合价及常见反应类型,题目难度不大.

练习册系列答案
相关题目
氰气的化学式为(CN)2,它的性质和卤素相似,称为拟卤素,对其性质和有关化合物性质的叙述不正确的是( )
| A、AgCN难溶于水 |
| B、MnO2不能与HCN反应生成(CN)2 |
| C、HCN易形成白雾 |
| D、(CN)2和NaOH溶液反应生成NaCN、NaCNO和H2O |
已知:MnO4-+H2O2+H+-Mn2++O2↑+H2O(未配平),若反应中转移2mol电子,则参加反应的H+的物质的量是( )
| A、2.0 mol |
| B、1.6 mol |
| C、1.2 mol |
| D、0.8 mol |
下列条件下,两瓶气体所含原子数、分子数一定相等的是( )
| A、同温度、同体积的N2和CO |
| B、同密度、同体积的H2和N2、 |
| C、同温度、同压强的C2H4和C3H6 |
| D、同质量、不同密度的N2O和CO2 |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,含有NA个氦原子的氦气的体积约为11.2L |
| B、标准状况下,44.8L H2O的分子数为2NA |
| C、常温常压下,22g CO2含有原子总数为1.5NA |
| D、含有1mol HCl 的稀盐酸与足量的铁发生反应,转移的电子总数为2NA |
下列化学用语书写正确的是( )
| A、熔融状态下NaHSO4电离方程式:NaHSO4=Na++H++SO42- |
| B、碳酸氢铵溶液中加入足量氢氧化钠:HCO3-+OH-=CO32-+H2O |
| C、钠投入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| D、氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- |
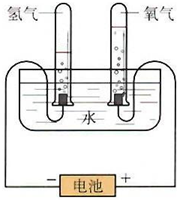 某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究.请按要求填写.
某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究.请按要求填写.