题目内容
6.一定量的CO2与足量碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示: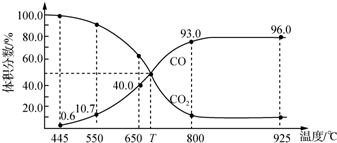
下列说法正确的是( )
| A. | 550℃时,若充入惰性气体,v(正)、v(逆)均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,此反应的平衡常数K=2 304,保持温度不变,若缩小体积,K值将变小 |
分析 A.可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,则v正,v退均减小,又改反应是气体体积增大的反应,则平衡正向移动;
B.由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,根据三段式进行计算;
C.由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态;
D.平衡常数只与温度有关.
解答 解:A.可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,平衡向着正向移动,v正,v逆均减小,故A错误;
B.由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,转化了xmol,
则有C(s)+CO2(g)?2CO(g)
开始 1 0
转化 x 2x
平衡; 1-x 2x
所以$\frac{2x}{1-x+2x}$×100%=40%,解得x=0.25mol,则CO2的转化率为:$\frac{0.25}{1}$×100%=25%,故B正确;
C.由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,所以平衡不移动,故C错误;
D.925℃时,平衡常数只与温度有关,缩小体积,K不变,故D错误.
故选:B.
点评 本题考查了化学平衡的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列对一些实验事实及其理论解释都正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能小于O原子 | 同周期元素原子的电离能随原子序数增大而增大 |
| B | CO2为直线形分子 | CO2分子中C为sp杂化,键角为180° |
| C | 金刚石的熔点高于石墨 | 金刚石是原子晶体,石墨是分子晶体 |
| D | HF的沸点低于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
14.铝能用于冶炼难溶的金属(如Cr、V、Mn等),这是因为铝( )
| A. | 既能与酸反应,又能与碱反应 | |
| B. | 导电性好 | |
| C. | 熔点低 | |
| D. | 具有还原性,在冶炼反应中放出大量的热量 |
11.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
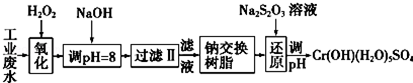
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
(1)氧化过程中可代替H2O2加入的试剂是A(填序号).
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:
该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;(填下列选项)已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.(填下列选项)
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:
该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
15. Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
(1)Z元素的原子基态时的电子排布式是1s22s22p63s23p63d104s1
(2)下列叙述正确的是d
a.Q的最简单气态氢化物比R的气体氢化物稳定
b.Q的含氧酸一定比R的含氧酸酸性强
c.R的气态氢化物的熔点在同族元素形成的氢化物中最低
d.R的第一电离能、电负性都比Q大
(3)Q和T可形成两种常见化合物,分别表示为QT与QT2.QT分子中σ键π键的个数比为1:2;QT2分子中,Q原子采取sp杂化.
(4)笑气(R2T)是一种麻醉剂,有关理论认为R2T与QT2具有相似的结构.故的空间构型为直线形,且为非极性(填“极性”或“非极性”)分子.
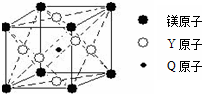
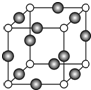
(5)现有Q、Y和镁三种元素的某种晶体具有超导性,其晶胞结构如图所示.该晶体的化学式为MgNi3C;晶体中每个镁原子周围距离相等且最近的Y原子有12个.
 Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:| 元素 | 相关信息 |
| Q | Q的单质是实验室常用的惰性电极材料 |
| R | R原子基态时2p原子轨道上有3个未成对电子 |
| T | 负二价的元素T的氢化物在通常情况下是一种液体,且 T的质量分数为88.9% |
| X | X是第三周期电负性最大的元素 |
| Y | 元素Y位于周期表第10列 |
| Z | Z存在质量数为65,中子数为36的核素 |
(2)下列叙述正确的是d
a.Q的最简单气态氢化物比R的气体氢化物稳定
b.Q的含氧酸一定比R的含氧酸酸性强
c.R的气态氢化物的熔点在同族元素形成的氢化物中最低
d.R的第一电离能、电负性都比Q大
(3)Q和T可形成两种常见化合物,分别表示为QT与QT2.QT分子中σ键π键的个数比为1:2;QT2分子中,Q原子采取sp杂化.
(4)笑气(R2T)是一种麻醉剂,有关理论认为R2T与QT2具有相似的结构.故的空间构型为直线形,且为非极性(填“极性”或“非极性”)分子.
(5)现有Q、Y和镁三种元素的某种晶体具有超导性,其晶胞结构如图所示.该晶体的化学式为MgNi3C;晶体中每个镁原子周围距离相等且最近的Y原子有12个.
 .
. 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子. .
.