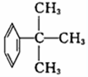
题目内容
化学的特征就是认识 和制造 ,它是一门具有创造性的科学.
考点:化学的主要特点与意义
专题:化学应用
分析:分子是保持物质化学性质的最小微粒,化学反应是有新物质生成的过程.
解答:
解:分子是保持物质化学性质的最小微粒,化学反应是有新物质即新分子生成的过程.故化学的特征就是认识分子和制造和制造分子.故答案为:分子;分子.
点评:本题考查了化学的主要特点和意义,难度不大.

练习册系列答案
相关题目
(1)写出NaHSO4的电离方程式 ;
(2)若向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42-恰好完全沉淀,试写出该反应的离子方程式 .
(3)写出碳酸钙与盐酸反应的离子方程式 .
(2)若向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42-恰好完全沉淀,试写出该反应的离子方程式
(3)写出碳酸钙与盐酸反应的离子方程式
某化学反应的△H=+122kJ?mol-1,△S=-231J?mol-1?K-1,则此反应在下列哪种情况下可自发进行( )
| A、在任何温度下都能自发进行 |
| B、在任何温度下都不能自发进行 |
| C、仅在高温下自发进行 |
| D、仅在低温下自发进行 |
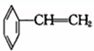 ②
② ③
③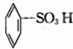 ④
④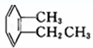 ⑤
⑤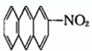
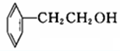 ⑦
⑦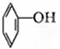 ⑧CH3CH=CH-COOH⑨
⑧CH3CH=CH-COOH⑨