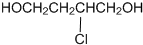
题目内容
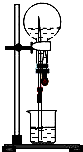 以下是针对喷泉实验所得溶液浓度问题的探讨,请根据题意回答问题.
以下是针对喷泉实验所得溶液浓度问题的探讨,请根据题意回答问题.(1)甲同学在标准状况下收集满一烧瓶的氯化氢气体,按如图所示组装好装置,引发喷泉,实验后液体充满整个烧瓶,请推算烧瓶中溶液的浓度为
(2)丙同学改用标准状况下纯的NO2做此实验,形成喷泉时发生反应的化学方程式为
,所得溶液浓度为
考点:氮的氧化物的性质及其对环境的影响,物质的量浓度的相关计算
专题:实验题
分析:(1)氨气溶于水,溶液体积等于氨气体积,令氨气的体积为22.4L,则溶液的体积为22.4L,根据n=
计算氨气的物质的量,再根据c=
计算溶液的物质的量浓度;相同条件下做同一实验时,最后液体并未充满整个烧瓶,说明收集的气体不纯含有空气,或装置漏气造成,依据计算过程分析可知气体溶解条件和溶液体积相同,溶质计算物质的量结合c=
计算得到所得到的溶液浓度相同;
(2)二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,依据反应前后气体体积变化和溶液体积变化计算溶液浓度,收集的是氧气和二氧化氮的混合气体,要使实验后液体充满整个烧瓶,按照反应比恰好完全吸收生成硝酸,4NO2+O2+2H2O=4HNO3,结合发反应前后气体体积和溶液体积变化计算溶液浓度,结合极值方法分析判断液体未能充满整个烧瓶,试讨论此情况下所得溶液的浓度取值;
| V |
| Vm |
| n |
| V |
| n |
| V |
(2)二氧化氮和水反应生成硝酸和一氧化氮,3NO2+H2O=2HNO3+NO,依据反应前后气体体积变化和溶液体积变化计算溶液浓度,收集的是氧气和二氧化氮的混合气体,要使实验后液体充满整个烧瓶,按照反应比恰好完全吸收生成硝酸,4NO2+O2+2H2O=4HNO3,结合发反应前后气体体积和溶液体积变化计算溶液浓度,结合极值方法分析判断液体未能充满整个烧瓶,试讨论此情况下所得溶液的浓度取值;
解答:
解:(1)氨气溶于水,溶液体积等于氨气体积,令氨气的体积为22.4L,则溶液的体积为22.4L,标况下22.4L氨气的物质的量=
=1mol,故所得溶液的物质的量浓度=
=0.045mol/L;相同条件下做同一实验时,最后液体并未充满整个烧瓶,说明收集的气体不纯含有空气,或装置漏气造成,依据计算过程分析可知气体溶解条件和溶液体积相同,溶质计算物质的量结合c=
计算得到所得到的溶液浓度相同,设圈套溶解条件为V,标准状况物质的量为
mol,溶液体积为V,则溶质浓度=
=
=0.045mol/L,反应浓度相同;
故答案为:0.045mol/L,收集的气体不纯含有空气,或装置气密性不好,相同;
(2)标准状况下纯的NO2做此实验,形成喷泉时发生反应的化学方程为:3NO2+H2O=2HNO3+NO;依据反应前后气体体积变化和溶液体积变化计算溶液浓度,设二氧化氮体积为3,则溶液体积为
,生成溶液中硝酸溶质物质的量在标准状况为
,得到溶质浓度=
=
mol/L=0.045mol/L,收集的是氧气和二氧化氮的混合气体,要使实验后液体充满整个烧瓶,按照反应比恰好完全吸收生成硝酸,4NO2+O2+2H2O=4HNO3,两者体积比V(O2):V(NO2)=1:4;结合反应前后气体体积和溶液体积变化计算溶液浓度,设二氧化氮体积为4,反应后溶液体积为5,生成溶质物质的量=
mol,溶质物质的量浓度=
=0.036mol/L,结合极值方法分析判断液体未能充满整个烧瓶,试讨论此情况下所得溶液的浓度取值为:若全部是二氧化氮浓度为0.045mol/L,若全部是二氧化氮和氧气4:1,溶质浓度为0.036mol/L,;
实验时液体未能充满整个烧瓶,试讨论此情况下所得溶液的浓度的取值范围是0.036mol/L~0.045mol/L;
故答案为:3NO2+H2O=2HNO3+NO,0.045,1:4,0.036,0.036mol/L~0.045mol/L;
| 22.4L |
| 22.4L/mol |
| 1mol |
| 22.4L |
| n |
| V |
| V |
| 22.4 |
| ||
| V |
| 1mol |
| 22.4L |
故答案为:0.045mol/L,收集的气体不纯含有空气,或装置气密性不好,相同;
(2)标准状况下纯的NO2做此实验,形成喷泉时发生反应的化学方程为:3NO2+H2O=2HNO3+NO;依据反应前后气体体积变化和溶液体积变化计算溶液浓度,设二氧化氮体积为3,则溶液体积为
| 2 |
| 3 |
| ||
| 22.4 |
| ||
|
| 1 |
| 22.4 |
| 4 |
| 22.4 |
| ||
| 5 |
实验时液体未能充满整个烧瓶,试讨论此情况下所得溶液的浓度的取值范围是0.036mol/L~0.045mol/L;
故答案为:3NO2+H2O=2HNO3+NO,0.045,1:4,0.036,0.036mol/L~0.045mol/L;
点评:本题考查了气体性质和溶液浓度的计算分析,通过回答本题可知有些题目需要结合物理知识来回答,气体溶解后溶液浓度的计算分析,掌握基础是关键,题目难度中等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
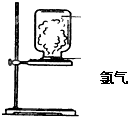 如图,取一块黄豆大小的金属钠放在石棉网上,用酒精灯预热,待钠熔成球状时,将盛氯气的集气瓶倒扣在钠的上方,钠会在氯气中剧烈燃烧,产生大量白烟,请回答下列问题:
如图,取一块黄豆大小的金属钠放在石棉网上,用酒精灯预热,待钠熔成球状时,将盛氯气的集气瓶倒扣在钠的上方,钠会在氯气中剧烈燃烧,产生大量白烟,请回答下列问题:
 空气质量与我们的健康息息相关,目前我国通过监测6项污染物的百分比浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的百分比浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.