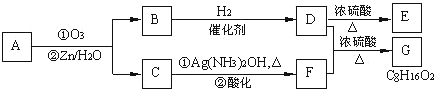
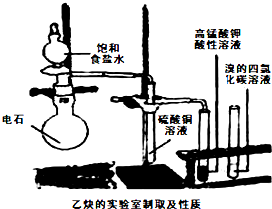
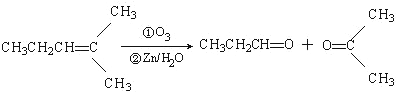题目内容
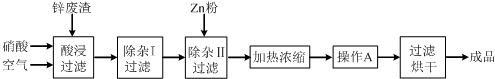
榴石矿石可以看作CaO、FeO、Fe2O3、A12O3、SiO2组成.工业上对其进行综合利用的流程如下:
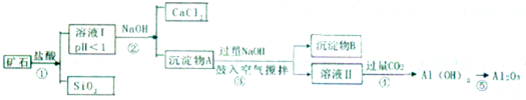
(1)SiO2的用途广泛,试写出其中的一种重要用途 ;
(2)溶液Ⅰ中除了Ca2+外,还含有的金属阳离子有 ;
(3)步骤③中NaOH参加反应的离子方程式是 ,鼓入空气并充分搅拌的目的是 .
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是 .
(5)试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象) .

(1)SiO2的用途广泛,试写出其中的一种重要用途
(2)溶液Ⅰ中除了Ca2+外,还含有的金属阳离子有
(3)步骤③中NaOH参加反应的离子方程式是
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是
(5)试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题,元素及其化合物
分析:榴石矿石可以看作CaO、FeO、Fe2O3、A12O3、SiO2组成,加入盐酸溶解过滤得到滤液中含氯化钙、氯化亚铁、氯化铁、氯化铝、盐酸,固体为SiO2,溶液中加入氢氧化钠反应生成氢氧化铁、氢氧化亚铁、氢氧化铝,过滤得到沉淀物A加热过量氢氧化钠通入空气,氧化氢氧化亚铁生成沉淀物氢氧化铁和溶液Ⅱ为偏铝酸钠溶液,通入过量二氧化碳生成氢氧化铝沉淀,加热分解生成氧化铝;
(1)二氧化硅可以制备光导纤维;
(2)溶液Ⅰ除去钙离子,含有阳离子Fe2+、Fe3+、Al3+;
(3)步骤③中NaOH参加反应和氢氧化铝反应生成偏铝酸钠溶液,鼓入空气充分搅拌使为了氢氧化亚铁氧化为氢氧化铁;
(4)步骤④通入过量CO2而不加入盐酸的原因是避免盐酸过量使氢氧化铝溶解,二氧化碳制备方法简单价格便宜;
(5)取少量矿石加入稀硫酸溶解后加入高锰酸钾溶液若褪色证明含有氧化亚铁;
(1)二氧化硅可以制备光导纤维;
(2)溶液Ⅰ除去钙离子,含有阳离子Fe2+、Fe3+、Al3+;
(3)步骤③中NaOH参加反应和氢氧化铝反应生成偏铝酸钠溶液,鼓入空气充分搅拌使为了氢氧化亚铁氧化为氢氧化铁;
(4)步骤④通入过量CO2而不加入盐酸的原因是避免盐酸过量使氢氧化铝溶解,二氧化碳制备方法简单价格便宜;
(5)取少量矿石加入稀硫酸溶解后加入高锰酸钾溶液若褪色证明含有氧化亚铁;
解答:
解:榴石矿石可以看作CaO、FeO、Fe2O3、A12O3、SiO2组成,加入盐酸溶解过滤得到滤液中含氯化钙、氯化亚铁、氯化铁、氯化铝、盐酸,固体为SiO2,溶液中加入氢氧化钠反应生成氢氧化铁、氢氧化亚铁、氢氧化铝,过滤得到沉淀物A加热过量氢氧化钠通入空气,氧化氢氧化亚铁生成沉淀物氢氧化铁,和溶液Ⅱ为偏铝酸钠溶液,通入过量二氧化碳生成氢氧化铝沉淀,加热分解生成氧化铝;
(1)二氧化硅可以制备光导纤维,故答案为:光导纤维;
(2)依据流程分析判断,溶液Ⅰ除去钙离子,含有阳离子Fe2+、Fe3+、Al3+,故答案为:Fe2+、Fe3+、Al3+;
(3)步骤③中NaOH参加反应和氢氧化铝反应生成偏铝酸钠溶液,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,鼓入空气充分搅拌使为了氢氧化亚铁氧化为氢氧化铁,故答案为:Al(OH)3+OH-=AlO2-+2H2O;使其中氢氧化亚铁氧化为氢氧化铁;
(4)步骤④通入过量CO2而不加入盐酸的原因是避免盐酸过量使氢氧化铝溶解,二氧化碳制备方法简单价格便宜,
故答案为:使用二氧化碳可以避免盐酸过量使氢氧化铝溶解,同时二氧化碳容易制备价格便宜;
(5)取少量矿石加入稀硫酸溶解后充分反应,滴入高锰酸钾溶液若褪色证明矿石中含有氧化亚铁,
故答案为:取少量矿石加入稀硫酸溶解后充分反应,滴入高锰酸钾溶液若褪色证明矿石中含有氧化亚铁.
(1)二氧化硅可以制备光导纤维,故答案为:光导纤维;
(2)依据流程分析判断,溶液Ⅰ除去钙离子,含有阳离子Fe2+、Fe3+、Al3+,故答案为:Fe2+、Fe3+、Al3+;
(3)步骤③中NaOH参加反应和氢氧化铝反应生成偏铝酸钠溶液,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,鼓入空气充分搅拌使为了氢氧化亚铁氧化为氢氧化铁,故答案为:Al(OH)3+OH-=AlO2-+2H2O;使其中氢氧化亚铁氧化为氢氧化铁;
(4)步骤④通入过量CO2而不加入盐酸的原因是避免盐酸过量使氢氧化铝溶解,二氧化碳制备方法简单价格便宜,
故答案为:使用二氧化碳可以避免盐酸过量使氢氧化铝溶解,同时二氧化碳容易制备价格便宜;
(5)取少量矿石加入稀硫酸溶解后充分反应,滴入高锰酸钾溶液若褪色证明矿石中含有氧化亚铁,
故答案为:取少量矿石加入稀硫酸溶解后充分反应,滴入高锰酸钾溶液若褪色证明矿石中含有氧化亚铁.
点评:本题考查了物质分离方法和流程分析判断,主要是实验操作和物质性质的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述不正确的是( )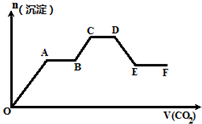

| A、O~A段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O |
| B、A~B段反应的离子方程式是2OH-+CO2═CO32-+H2O |
| C、A~B段与C~D段所发生的反应相同 |
| D、D~E段沉淀的减少是由于碳酸钡固体的溶解所致 |
 电子工业常用30%的FeCl3 溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板.
电子工业常用30%的FeCl3 溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板.