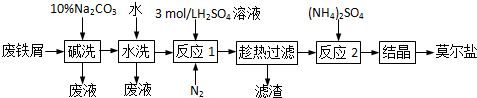
题目内容
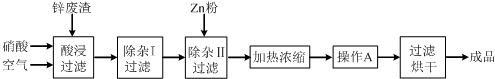
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2?6H2O晶体,其工艺流程为:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是 .
(2)在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将Fe2+氧化为 ,便于调节溶液的pH使铁元素转化为氢氧化物沉淀除去.为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 ~ .检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加 溶液,若不出现血红色,表明Fe3+沉淀完全.
(3)加入Zn粉的作用是除去溶液中的 .

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
(2)在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将Fe2+氧化为
(3)加入Zn粉的作用是除去溶液中的
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:生产Zn(NO3)2?6H2O晶体,其工艺流程为:冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),加入硝酸通入空气酸浸过滤后得到滤液含有Zn2+、Fe3+、Fe2+(少量)、Cu2+、Al3+,在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将未被氧化的Fe2+氧化为Fe3+,调节溶液PH使铁离子、铝离子全部沉淀,过滤后滤液中加入锌除去铜离子,过滤得到硫酸锌溶液,加热蒸发,浓缩结晶,过滤洗涤得到ZnSO4?6H2O晶体;
(1)根据一项化学反应速率的因素考虑,从温度、浓度、增大接触面积等分析增大反应速率;
(2)H2O2与Fe2+发生氧化还原反应生成铁离子;根据沉淀和pH表分析控制溶液的pH,利用铁离子与KSCN反应出现血红色来检验铁离子是否存在;
(3)锌比铜活泼,Zn与溶液中铜离子反应,冷却结晶得到Zn(NO3)2?6H2O晶体.
(1)根据一项化学反应速率的因素考虑,从温度、浓度、增大接触面积等分析增大反应速率;
(2)H2O2与Fe2+发生氧化还原反应生成铁离子;根据沉淀和pH表分析控制溶液的pH,利用铁离子与KSCN反应出现血红色来检验铁离子是否存在;
(3)锌比铜活泼,Zn与溶液中铜离子反应,冷却结晶得到Zn(NO3)2?6H2O晶体.
解答:
解:生产Zn(NO3)2?6H2O晶体,其工艺流程为:冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),加入硝酸通入空气酸浸过滤后得到滤液含有Zn2+、Fe3+、Fe2+(少量)、Cu2+、Al3+,在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将未被氧化的Fe2+氧化为Fe3+,调节溶液PH使铁离子、铝离子全部沉淀,过滤后滤液中加入锌除去铜离子,过滤得到硫酸锌溶液,加热蒸发,浓缩结晶,过滤洗涤得到ZnSO4?6H2O晶体;
(1)因适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等)可提高锌的浸出速率,所以在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取上述措施,
故答案为:适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等);
(2))“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,则加入适量H2O2溶液,目的是将Fe2+氧化为Fe3+;由表格中的数据可知,氢氧化锌开始沉淀的pH为5.4,氢氧化铝完全沉淀的pH为5.2,则为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4,又铁离子与KSCN反应出现血红色,则静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全,
故答案为:Fe3+;5.2;5.4;KSCN;
(3)根据金属活动顺序表可知,锌比铜活泼,由流程图及离子沉淀的pH,则加入Zn粉的作用除去溶液中的Cu2+,除杂后的溶液加热浓缩后、冷却结晶得到晶体,
故答案为:Cu2+.
(1)因适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等)可提高锌的浸出速率,所以在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取上述措施,
故答案为:适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等);
(2))“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,则加入适量H2O2溶液,目的是将Fe2+氧化为Fe3+;由表格中的数据可知,氢氧化锌开始沉淀的pH为5.4,氢氧化铝完全沉淀的pH为5.2,则为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4,又铁离子与KSCN反应出现血红色,则静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全,
故答案为:Fe3+;5.2;5.4;KSCN;
(3)根据金属活动顺序表可知,锌比铜活泼,由流程图及离子沉淀的pH,则加入Zn粉的作用除去溶液中的Cu2+,除杂后的溶液加热浓缩后、冷却结晶得到晶体,
故答案为:Cu2+.
点评:本题考查晶体的制备及混合物的分离、提纯,注意已知信息与所学知识的结合来分析解答问题,除杂流程及表格数据是解答本题的关键,题目难度中等.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
在某无色透明的酸性溶液中,能共存的离子组是( )
| A、NH4+、NO3-、Mg2+、SO42- |
| B、Na+、OH-、K+、NO3- |
| C、MnO4-、K+、SO42-、Na+ |
| D、K+、SO42-、HCO3-、Na+ |
辨析以下的说法:
①l6O与l8O的转化可以通过化学反应实现;
②灼烧钠的化合物时火焰呈黄色,那是发生了化学反应;
③碱性氧化物一定是金属氧化物;
④只由一种元素组成的物质一定是纯净物;
⑤石墨与金刚石的转化是化学变化;上述说法中正确的是( )
①l6O与l8O的转化可以通过化学反应实现;
②灼烧钠的化合物时火焰呈黄色,那是发生了化学反应;
③碱性氧化物一定是金属氧化物;
④只由一种元素组成的物质一定是纯净物;
⑤石墨与金刚石的转化是化学变化;上述说法中正确的是( )
| A、③⑤ | B、②④ | C、④⑤ | D、①③ |
下列物质中属于纯净物、化合物、盐、钙盐的是( )
| A、CaO |
| B、Ca(OH) |
| C、CaCO3 |
| D、CH4 |
下列实验方案不合理的是( )
| A、鉴定蔗糖酸性水解产物中有葡萄糖:直接在水解液中加入新制Cu(OH)2悬浊液,加热 |
| B、鉴别织物成分是真丝还是人造丝:用灼烧的方法 |
| C、鉴别乙醇、乙酸和乙酸乙酯:用碳酸钠溶液 |
| D、实验室制溴苯:将苯、液溴和铁粉混合即可 |
下列实验操作中数据合理的是( )
| A、用10 mL 量筒量取5.2 mL盐酸 |
| B、用广泛pH试纸测得某溶液的pH值为12.5 |
| C、用托盘天平称取25.12gNaCl固体 |
| D、用100 mL容量瓶配制50mL0.1 mol/L的盐酸 |