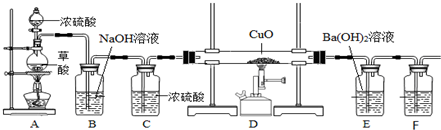
题目内容
1.下列事实不能用勒夏特列原理解释的是( )| A. | 氯化铁溶液加热蒸干最终得不到氯化铁固体 | |
| B. | 用热的纯碱溶液清洗油污效果好 | |
| C. | 在H2、I2和HI组成的平衡体系加压后,混合气体颜色变深 | |
| D. | 常温下,将1 mL pH=3的醋酸溶液加水稀释至100 mL,测得其pH<5 |
分析 勒夏特列原理是指如果改变影响平衡的一个条件(如浓度,压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特列原理适用于可逆反应,结合题目解答该题.
解答 解:A.盐类的水解为吸热过程,加热促进水解,氯化铁溶液加热蒸干最终得到氢氧化铁,如温度过高,得到氧化铁,故A不选;
B.碳酸根水解CO32-+H2O?HCO3-+OH-,溶液呈碱性,水解过程是吸热过程,升高温度促进碳酸根水解,碱性增强,去油污能力增强,能用勒夏特利原理解释,故B不选;
C.H2、I2、HI三者的平衡,增大压强平衡不移动,但浓度增大,则颜色加深,不能用勒沙特列原理解释,故C选;
D.醋酸为弱电解质,加水促进电离,则常温下,将1mL pH=3的醋酸溶液加水稀释至100ml,测得其PH<5,能用勒夏特列原理解释,故D不选;
故选C.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.2-羟基丁二酸俗名苹果酸(HOOCCHOHCH2COOH)是重要的食品添加剂,有多种同分异构体,其中和苹果酸官能团的种类和数目都相同的同分异构体有(不考虑立体异构)( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
16.下列用系统命名法命名的烷烃名称正确的是( )
| A. | 2-甲基-3-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2-甲基-4-乙基戊烷 | D. | 1,2-二甲基丁烷 |
6.下列说法不正确的是( )
| A. | 将少量氯化钴晶体溶于一定浓度的盐酸溶液呈紫色,加热后溶液颜色变成蓝色 | |
| B. | 中和热测定实验中,环形玻璃搅拌棒不能用铜质搅拌棒代替 | |
| C. | 容量瓶、分液漏斗、滴定管使用时都必须检查是否漏水 | |
| D. | 滴定管水洗后必须烘干才能使用 |
13.1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,如表给出的是原子序数小于20的16种元素的电负性数值:
请仔细分析,回答下列有关问题:
(1)预测周期表中电负性最大的元素应为F;估计钙元素的电负性的取值范围:0.8<X<1.2.
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是自上而下电负性降低;
简述元素电负性X的大小与元素金属性、非金属性之间的关系非金属性越强电负性越大,金属性越强电负性越小.
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为共价键,其理由是AlCl3中两电负性之差为1.5,Br元素的电负性小于Cl元素电负性,AlBr3中两电负性之差小于1.5.
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(1)预测周期表中电负性最大的元素应为F;估计钙元素的电负性的取值范围:0.8<X<1.2.
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是自上而下电负性降低;
简述元素电负性X的大小与元素金属性、非金属性之间的关系非金属性越强电负性越大,金属性越强电负性越小.
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为共价键,其理由是AlCl3中两电负性之差为1.5,Br元素的电负性小于Cl元素电负性,AlBr3中两电负性之差小于1.5.
10.下列微粒中:
①13Al3+ ②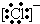 ③
③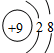 ④F- 其中核外电子数相同的是( )
④F- 其中核外电子数相同的是( )
①13Al3+ ②
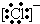 ③
③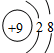 ④F- 其中核外电子数相同的是( )
④F- 其中核外电子数相同的是( )| A. | ①③ | B. | ②③④ | C. | ②④ | D. | ①③④ |
11.下列实验方案能达到目的( )
| A. | 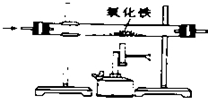 除去CO中的CO2 除去CO中的CO2 | B. | 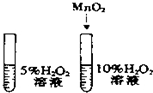 探究二氧化锰对反应速率的影响 探究二氧化锰对反应速率的影响 | ||
| C. | 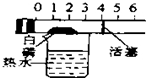 探究空气中氧气的含量 探究空气中氧气的含量 | D. | 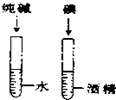 探究溶解性的影响因素 探究溶解性的影响因素 |
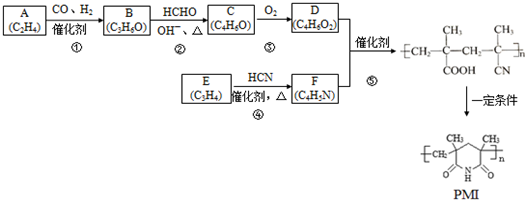
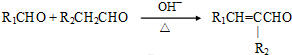 (注:R1可以是烃基本,也可以是H原子)
(注:R1可以是烃基本,也可以是H原子)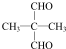 .
.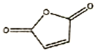 和
和 反应可制备
反应可制备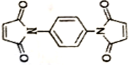 .然后以
.然后以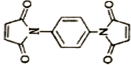 为单体发生聚合反应可合成另一种聚亚酰胺树脂X.该聚合反应的化学方程式为:n
为单体发生聚合反应可合成另一种聚亚酰胺树脂X.该聚合反应的化学方程式为:n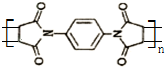 (X中无碳碳双键)
(X中无碳碳双键)