题目内容
(1)在KCl和CaCl2所组成的某混合物中,K+与Ca2+的物质的量之比为2:1,则KCl与CaCl2的物质的量之比为 ,含1mol Cl-的该混合物的质量是 g
(2)在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,该混合气体中,CO和CO2 的物质的量之比为
(3)12.4gNa2X中含Na+0.4mol,则Na2X的摩尔质量是 ,X的相对原子质量是 .
(2)在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,该混合气体中,CO和CO2 的物质的量之比为
(3)12.4gNa2X中含Na+0.4mol,则Na2X的摩尔质量是
考点:物质的量的相关计算,摩尔质量
专题:阿伏加德罗常数和阿伏加德罗定律
分析:(1)由化学式可知,n(K+)=n(KCl),n(Ca2+)=n(CaCl2),则n(KCl):n(CaCl2)=n(K+):n(Ca2+);
令氯化钙的物质的量为xmol,用x表示出氯化钾的物质的量,进而表示出氯离子的物质的量,据此计算x的值,再根据m=nM计算;
(2)令CO和CO2的物质的量分别为xmol、ymol,根据二者质量之和与二者体积之和列方程计算x、y的值;
(3)由钠离子物质的量计算Na2X的物质的量,根据M=
计算Na2X的摩尔质量,进而计算X的相对原子质量.
令氯化钙的物质的量为xmol,用x表示出氯化钾的物质的量,进而表示出氯离子的物质的量,据此计算x的值,再根据m=nM计算;
(2)令CO和CO2的物质的量分别为xmol、ymol,根据二者质量之和与二者体积之和列方程计算x、y的值;
(3)由钠离子物质的量计算Na2X的物质的量,根据M=
| m |
| n |
解答:
解:(1)由化学式可知,n(K+)=n(KCl),n(Ca2+)=n(CaCl2),则n(KCl):n(CaCl2)=n(K+):n(Ca2+)=2:1;
令氯化钙的物质的量为xmol,则氯化钾的物质的量为2xmol,则2x+2x=1,解x=0.25,故混合物的总质量=0.25mol×111g/mol+0.25mol×2×74.5g/mol=65g,
故答案为:2:1;65g;
(2)令CO和CO2的物质的量分别为xmol、ymol,根据二者质量之和与二者体积之和列方程,则:
,解得x=0.04,y=0.02,
故CO和CO2 的物质的量之比为0.04mol:0.02mol=2:1,
故答案为:2:1;
(3)Na2X的物质的量=
=0.2mol,其质量为12.4g,故Na2X的摩尔质量=
=62g/mol,故X的相对原子质量=62-23×2=16,
故答案为:62g/mol;16.
令氯化钙的物质的量为xmol,则氯化钾的物质的量为2xmol,则2x+2x=1,解x=0.25,故混合物的总质量=0.25mol×111g/mol+0.25mol×2×74.5g/mol=65g,
故答案为:2:1;65g;
(2)令CO和CO2的物质的量分别为xmol、ymol,根据二者质量之和与二者体积之和列方程,则:
|
故CO和CO2 的物质的量之比为0.04mol:0.02mol=2:1,
故答案为:2:1;
(3)Na2X的物质的量=
| 0.4mol |
| 2 |
| 12.4g |
| 0.2mol |
故答案为:62g/mol;16.
点评:本题考查混合物的有关计算,侧重考查物质的量有关计算,比较基础,注意基础知识的理解掌握.

练习册系列答案
相关题目
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g)△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
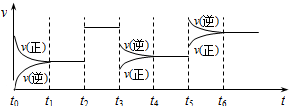

| A、t2时加入了催化剂(其它条件不变) |
| B、t3时降低了温度(其它条件不变) |
| C、t5时增大了压强(缩小容器体积,其它条件不变) |
| D、平衡状态时,t6时刻Z的百分含量最低 |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、1 molCl2与足量Fe反应转移电子数一定为3NA |
| B、标准状况下,2.24 L NH3中含有共价键的数目为NA |
| C、1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
| D、标况下,11.2 L CCl4所含的分子数目为0.5NA |
下列表示对应化学反应的离子方程式正确的是( )
A、MnO2 与浓盐酸反应制Cl2:MnO2+4HCl
| ||||
| B、明矾溶于水产生Al(OH)3 胶体:Al3++3H2O═Al(OH)3↓+3H+ | ||||
| C、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | ||||
| D、Na2O2 溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ |
在下列物质中,化合物类型相同的一组是( )
| A、NaCl HCl |
| B、CO2 H2O |
| C、H2CO3 KCl |
| D、MgCl2 SO2 |
下列说法正确的是( )
| A、金属氧化物都能与水反应生成碱 |
| B、非金属氧化物都能与水反应生成酸 |
| C、氧化铝既能与酸反应又能与氨水反应 |
| D、氧化铝坩埚不能用于熔融烧碱 |
铜易生锈,铜合金更易生锈,铜器上往往覆盖着一层铜绿,铜绿的主要成分是( )
| A、CuO |
| B、Cu(OH)2 |
| C、Cu2O |
| D、Cu2(OH)2CO3 |