题目内容
5.在铜的催化作用下氨气和氟气反应,得到两种氟化物,一种是离子化合物M,另一种是共价化合物N且其分子构型与氨气类似,下列有关说法错误的是( )| A. | 该反应中氧化剂与还原剂物质的量之比为3:4 | |
| B. | 该反应中氧化产物与还原产物物质的量之比为1:4 | |
| C. | N是氧化产物,而且是极性分子 | |
| D. | M是还原产物,其还原性比NH3弱 |
分析 氨气和氟气之间发生氧化还原反应,该反应的化学方程式为4NH3+3F2=NF3+3NH4F,反应中N元素化合价升高,F元素化合价降低,氨气表现了还原性,F2为氧化剂,结合元素化合价的变化解答该题.
解答 解:反应的化学方程式为4NH3+3F2=NF3+3NH4F,
A.N元素的化合价升高,F元素的化合价降低,且4molNH3中只有1mol作还原剂,则氧化剂与还原剂物质的量之比为3:1,故A错误;
B.氧化产物为NF3,还原产物为NF3、NH4F,则该反应中氧化产物与还原产物物质的量之比为1:4,故B正确;
C.N为NF3,与氨气结构相似,为极性分子,氧化产物为NF3,故C正确;
D.M为NH4F,为还原产物,由还原剂的还原性大于还原产物的还原性可知,其还原性比NH3弱,故D正确;
故选A.
点评 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握题给信息,从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,题目难度不大.

练习册系列答案
相关题目
15.生活中的如图制品没有用到高分子材料的是( )
| A. |  电话卡 | B. |  塑料袋 | C. |  不锈钢锅 | D. |  尼龙雨衣 |
20.设NA表示阿伏加德罗常数的,下列说法正确的是( )
| A. | 32 g氧气(O2)和32g臭氧(O3)所含氧原子数都为2NA | |
| B. | 18g水中所含电子数为8NA | |
| C. | 常温常压下,1 mol氖气原子数为2NA | |
| D. | 常温常压下,111.2L氮气所含氮原子数为NA |
11.有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:

部分实验现象(1)中 a极质量减小,b极质量增加,(2)中 b极有气体产生,c极无变化,(3)中d极溶解,c极有气体产生,(4)中 电流计指示在导线中,电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )

部分实验现象(1)中 a极质量减小,b极质量增加,(2)中 b极有气体产生,c极无变化,(3)中d极溶解,c极有气体产生,(4)中 电流计指示在导线中,电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
| A. | a>b>c>d | B. | b>c>d>a | C. | d>a>b>c | D. | a>b>d>c |
8.葡萄糖酸钙是一种可促进骨骼生长的营养物质.葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见表:
实验流程如下:
C6H12O6溶液$→_{①}^{滴加3%溴水/55℃}$$→_{②}^{过量CaCO_{3}/70℃}$$→_{③}^{趁热过滤}$$→_{④}^{乙醇}$悬浊液$→_{⑤}^{抽滤}$$→_{⑥}^{洗涤}$$→_{⑦}^{干燥}$Ca(C6H11O7)2
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,如图装置最合适的是B.

制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是C.
A.新制CuOH2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖的转化率;本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应得到葡萄糖酸钙.
(3)第③步需趁热过滤,其原因是葡萄糖酸钙冷却后会结晶,如不趁热过滤会损失产品.
(4)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶液中的溶解度,有利于葡萄糖酸钙的析出.
(5)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
C6H12O6溶液$→_{①}^{滴加3%溴水/55℃}$$→_{②}^{过量CaCO_{3}/70℃}$$→_{③}^{趁热过滤}$$→_{④}^{乙醇}$悬浊液$→_{⑤}^{抽滤}$$→_{⑥}^{洗涤}$$→_{⑦}^{干燥}$Ca(C6H11O7)2
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,如图装置最合适的是B.

制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是C.
A.新制CuOH2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖的转化率;本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应得到葡萄糖酸钙.
(3)第③步需趁热过滤,其原因是葡萄糖酸钙冷却后会结晶,如不趁热过滤会损失产品.
(4)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶液中的溶解度,有利于葡萄糖酸钙的析出.
(5)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
9.乙醇在发生催化氧化时,化学键断裂的位置是(如图)( )


| A. | ②③ | B. | ②④ | C. | ①③ | D. | ③④ |
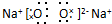 ,甲中的化学键类型为离子键、共价键.
,甲中的化学键类型为离子键、共价键. 已知SnCl4、SiCl4、AlCl3、PCl3、PCl5等氯化物在潮湿的空气中都有白雾生成.为清楚地观察磷在氯气中燃烧,达到PCl3和PCl5分步生成的目的,可预先把干燥的氯气贮存在100mL的注射器内,再把火柴头大小的红磷置于玻璃燃烧匙上烘干后组成如图所示的装置.
已知SnCl4、SiCl4、AlCl3、PCl3、PCl5等氯化物在潮湿的空气中都有白雾生成.为清楚地观察磷在氯气中燃烧,达到PCl3和PCl5分步生成的目的,可预先把干燥的氯气贮存在100mL的注射器内,再把火柴头大小的红磷置于玻璃燃烧匙上烘干后组成如图所示的装置. 室温下:
室温下: