题目内容
X、Y是周期表中前20号中两种元素(非稀有气体元素),X原子的半径比Y的半径小,且具有相同的电子层数,下列有关叙述正确的是(选项中m、n均为正整数)( )
| A、若Y最高价为+5,则X最高价一定为+6或+7 |
| B、若Y元素形成的单质是气体,则X元素形成的单质一定也是气体 |
| C、若HnXOm为强酸,则X的氢化物溶液于水一定显酸性 |
| D、X的离子半径一定比Y离子半径小 |
考点:原子结构与元素的性质
专题:元素周期律与元素周期表专题
分析:X、Y是周期表中前20号中两种元素(非稀有气体元素),X原子的半径比Y的半径小,且具有相同的电子层数,则X、Y属于同一周期元素,且X原子序数大于Y,
A.若Y最高化合价为+5价,X可能没有正化合价;
B.若Y元素形成的单质是气体,则Y可能是N、O元素,X可能是O或F元素;
C.若HnXOm为强酸,则X的氢化物溶液于水可能显碱性;
D.电子层结构相同的离子,离子半径随着原子序数增大而减小,电子层数越多其离子半径越大.
A.若Y最高化合价为+5价,X可能没有正化合价;
B.若Y元素形成的单质是气体,则Y可能是N、O元素,X可能是O或F元素;
C.若HnXOm为强酸,则X的氢化物溶液于水可能显碱性;
D.电子层结构相同的离子,离子半径随着原子序数增大而减小,电子层数越多其离子半径越大.
解答:
解:X、Y是周期表中前20号中两种元素(非稀有气体元素),X原子的半径比Y的半径小,且具有相同的电子层数,则X、Y属于同一周期元素,且X原子序数大于Y,
A.若Y最高化合价为+5价,X可能没有正化合价,如F元素没有正化合价,故A错误;
B.若Y元素形成的单质是气体,Y可能是N、O元素,X可能是O或F元素,所以若Y元素形成的单质是气体,则X元素形成的单质一定也是气体,故B正确;
C.若HnXOm为强酸,则X的氢化物溶液于水可能显碱性,如硝酸是强酸但氨水溶液呈碱性,故C错误;
D.X的离子半径可能比Y离子半径大,如钠离子半径大于镁离子,故D错误;
故选B.
A.若Y最高化合价为+5价,X可能没有正化合价,如F元素没有正化合价,故A错误;
B.若Y元素形成的单质是气体,Y可能是N、O元素,X可能是O或F元素,所以若Y元素形成的单质是气体,则X元素形成的单质一定也是气体,故B正确;
C.若HnXOm为强酸,则X的氢化物溶液于水可能显碱性,如硝酸是强酸但氨水溶液呈碱性,故C错误;
D.X的离子半径可能比Y离子半径大,如钠离子半径大于镁离子,故D错误;
故选B.
点评:本题考查原子结构和性质,侧重考查物质性质、元素周期律知识,注意规律中的异常现象,易错选项是C,注意:大多数气态氢化物的水溶液呈酸性,但氨水溶液呈碱性.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
根据如图所示的过程中的能量变化情况,判断下列说法正确的是( )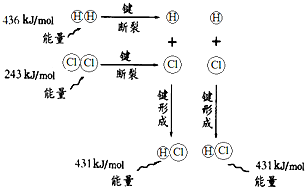

| A、H2(g)和Cl2(g)反应生成HCl(g)是吸热反应 |
| B、2个H原子结合生成一个H2分子时放出436kJ能量 |
| C、1molHCl(g)分子中的化学键断裂时需要吸收862kJ能量 |
| D、H2(g)+Cl2(g)═2HCl(g)的反应热△H=-183kJ?mol-1 |
下列说法或表示方法正确的是( )
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ |
| C、由C(石墨)═C(金刚石)△H=+1.90 kJ?mol-1可知,金刚石比石墨稳定 |
| D、500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成0.2molNH3(g),放热9.3kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ/mol |
居里夫人因发现了镭元素获得1911年诺贝尔化学奖,距今百年,这也是居里夫人第二次获得诺贝尔奖,广为世人称道.下列关于镭的性质的描述中不正确的是( )
| A、在化合物中呈+2价 |
| B、氢氧化物呈两性 |
| C、单质与水反应,放出氢气 |
| D、碳酸盐难溶于水 |
相同温度下,等体积的两个集气瓶分别盛
C,
N,
O三种原子构成的CO和N2下列说法正确的是( )
12 6 |
14 7 |
18 8 |
| A、质量和分子数相同 |
| B、若压强相同,则含有相同的质子数,但质量不同 |
| C、质量和分子数都不相同 |
| D、若压强相同,则含有相同的原子、质子、中子和电子 |
苯乙烯是一种重要的有机化工原料,其结构简式如图,它一般不可能具有的性质是( )


| A、易溶于水,不易溶于有机溶剂 |
| B、在空气中燃烧产生黑烟 |
| C、能使溴的四氯化碳溶液褪色,也能使酸性高锰酸钾溶液褪色 |
| D、能发生加成反应,在一定条件下可与4倍物质的量的氢气加成 |
下列离子方程式书写不正确的是( )
| A、二氧化硫通入NaOH溶液至过量:SO2+OH-=HSO3- |
| B、氯化铵溶液溶解少量氢氧化镁固体:2NH4++Mg(OH)2=Mg2++2NH3?H2O |
| C、硫酸氢钠溶液与足量氢氧化钡溶液反应:SO42-+Ba2++2H++2OH-=BaSO4↓+2H2O |
| D、铁粉溶于足量稀硝酸:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O |
已知下述三个实验均能发生化学反应.下列判断正确的是( )
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铜丝放入氯化铁溶液中 |
| A、上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
| B、实验①中铁钉只作还原剂 |
| C、实验②中Fe2+既显氧化性又显还原性 |
| D、实验③中发生的是置换反应 |
