题目内容
16.一定条件下反应N2(g)+3H2(g)?2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的化学反应速率为( )| A. | 1.2mol•(L•min) -1 | B. | 18mol•(L•min)-1 | C. | 0.6mol•(L•min) -1 | D. | 0.4mol•(L•min)-1 |
分析 在2min内△n=(20-8)mol=12mol,则氮气的平均化学反应速率=$\frac{\frac{△n}{V}}{△t}$,据此分析解答.
解答 解:在2min内△n=(20-8)mol=12mol,则氮气的平均化学反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{12mol}{10L}}{2min}$=0.6mol•(L•min) -1,故选C.
点评 本题考查化学反应速率的有关计算,为高频考点,明确化学反应速率中各个物理量的关系是解本题关键,侧重考查学生分析计算能力,题目难度不大.

练习册系列答案
相关题目
6.下列说法不正确的是( )
| A. | 用已知浓度NaOH溶液滴定未知浓度盐酸,滴定终点时,俯视刻度线,则测得盐酸浓度偏小 | |
| B. | 用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液 | |
| C. | 通常采用产生气泡的快慢,来比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 | |
| D. | 受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 |
7.下列离子方程式正确的是( )
| A. | 碳酸钠溶液与盐酸反应:Na2CO3+2H+═2Na++H2O+CO2↑ | |
| B. | 氧化铜与硫酸溶液反应:Cu2++2H+═Cu2++H2O | |
| C. | 锌与稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| D. | 硫酸铜溶液中放入铁片:3Cu2++2Fe═2Fe3++3Cu |
1.对于锌一铜一稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是( )
| A. | 锌片溶解了32.5 g | B. | 锌片增重32.5 g | ||
| C. | 铜片上析出lgH2 | D. | 铜片上析出1molH2 |
8.在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的物质的量增加了0.2mol,则反应速率为( )
| A. | v(H2)=0.06 mol/(L•min) | B. | v(NH3)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.04 mol/(L•min) | D. | v(N2)=0.04 mol/(L•min) |
5.下列物质之间互称同位素的是( )
| A. | 红磷、白磷 | B. | 1H、2H、3H | C. | O2、O3 | D. | 12C、14N |
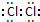 ;
;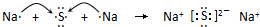 .
.