题目内容
3.将ag镁、铝合金溶解于足量的稀HNO3溶液中,再滴加1.0mol/L的Na0H溶液至1L时,开始出现沉淀,至4L时,沉淀质量达到最大值,则ag镁、铝合金,总物质的量为( )| A. | $\frac{a-3}{12}$mol | B. | $\frac{a-27}{12}$mol | C. | $\frac{a-81}{18}$mol | D. | $\frac{a-9}{18}$mol |
分析 滴加1.0mol/L的Na0H溶液至1L时,开始出现沉淀,说明稀硝酸过量,至4L时沉淀质量达到最大值,据此可知镁离子、铝离子生成氢氧化镁、氢氧化铝消耗了3L 1.0mol/L的NaOH溶液,然后设出Mg、Al的物质的量,分别根据质量、消耗氢氧化钠的我质量的列式计算即可.
解答 解:滴加1.0mol/L的Na0H溶液至1L时,开始出现沉淀,说明稀硝酸过量,至4L时沉淀质量达到最大值,据此可知镁离子、铝离子生成氢氧化镁、氢氧化铝消耗了3L 1.0mol/L的NaOH溶液,消耗NaOH的物质的量为:1.0mol/L×3L=3mol,
设镁、铝的物质的量分别为x、y,
则:24x+27y=a、2x+3y=3,联立解得:x=$\frac{a-27}{6}$mol、y=$\frac{36-a}{9}$mol,
则合金中Mg、Al的总物质的量为:x+y=$\frac{a-27}{6}$mol+$\frac{36-a}{9}$mol=$\frac{a-9}{18}$mol
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下表是元素周期表的一部分,回答下列问题:
(1)写出①、③两种元素形成的化合物有两种,其化学式分别为:CO,CO2.
(2)写出①元素最高价氧化物的电子式和结构式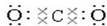 ,O=C=O.
,O=C=O.
(3)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.
(4)序号④⑤⑪的元素组成的化合物为NaClO,写出电子式 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)写出①元素最高价氧化物的电子式和结构式
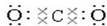 ,O=C=O.
,O=C=O.(3)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.
(4)序号④⑤⑪的元素组成的化合物为NaClO,写出电子式
 .
.
8.下列有关元素周期律、元素周期表的说法正确的是( )
| A. | 金属锗是一种良好的导热、导电材料 | |
| B. | 元素的非金属性越强,其氢化物的沸点越高 | |
| C. | 同周期相邻主族元素的原子,其质子数之差均为1 | |
| D. | 最外层电子数为4的原子,其元素一定处于ⅣA族 |
15.下列叙述不正确的是( )
| A. | 苯中的少量苯酚可先加适量的溴水,再过滤而除去 | |
| B. | 将苯酚晶体放人少量水中,加热时全部溶解,冷却后形成乳浊液 | |
| C. | 苯酚的酸性很弱,不能使酸碱指示剂变色 | |
| D. | 苯酚有毒,但其稀溶液可直接用作防腐剂和消毒剂 |
17.下列各原子或离子的电子排布式错误的是( )
| A. | Mg2+ 1s22s22p6 | B. | Br 1s22s22p63s23p63d104s24p5 | ||
| C. | O2- 1s22s22p6 | D. | Cr ls22s22p63s23p63d44s2 |
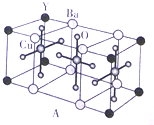 NH3称为叠氮酸,常温下为无色有刺激性气味的液体,N${\;}_{3}^{-}$也被称为类卤离子,用酸与叠氮化钠反应可制得叠氮酸,而叠氮化钠可从下列反应制得:NaNH2+N2O═NaN3+H2O,HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,溶解铜生成CuCl${\;}_{2}^{-}$.铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶泡如图,图中小黑球代表氧原子,其余大求为Y、Cu、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症,试回答下列问题:
NH3称为叠氮酸,常温下为无色有刺激性气味的液体,N${\;}_{3}^{-}$也被称为类卤离子,用酸与叠氮化钠反应可制得叠氮酸,而叠氮化钠可从下列反应制得:NaNH2+N2O═NaN3+H2O,HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,溶解铜生成CuCl${\;}_{2}^{-}$.铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶泡如图,图中小黑球代表氧原子,其余大求为Y、Cu、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症,试回答下列问题: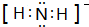 其中心原子的杂化类型是sp3
其中心原子的杂化类型是sp3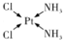 .
.
 .
.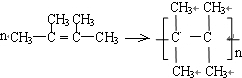 .
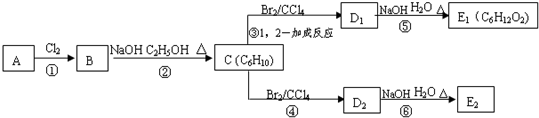
.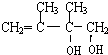 ;C的系统名称是2,3-二甲基-1,3丁二烯.
;C的系统名称是2,3-二甲基-1,3丁二烯. .
. ,由2个原子组成的分子是HF、阴离子是OH-.
,由2个原子组成的分子是HF、阴离子是OH-.