题目内容
6.下列说法正确的是( )| A. | 纯水的pH值一定等于7 | |
| B. | [H+]大于10-7mol/L的溶液一定是酸性溶液 | |
| C. | pH=2的溶液中[H+]是pH=1的溶液的两倍 | |
| D. | [H+]=2×10-7mol/L的溶液可能是中性溶液 |
分析 A.温度影响水的电离,则纯水的pH不一定为7;
B.溶液酸碱性取决于氢离子与氢氧根离子浓度大小,不能直接根据pH大小判断溶液酸碱性;
C.pH=2的溶液中氢离子浓度为0.01mol/L,pH=1的溶液中氢离子浓度为0.1mol/L;
D.若氢离子与氢氧根离子浓度相等,则溶液呈中性.
解答 解:A.纯水的pH值不一定等于7,如100℃时纯水的pH=6,故A错误;
B.[H+]大于10-7mol/L的溶液不一定是酸性溶液,如100℃时纯水的pH=6,故B错误;
C.pH=2的溶液中[H+]=0.01mol/L,pH=1的溶液中氢离子浓度为0.1mol/L,前者氢离子浓度是后者的$\frac{1}{10}$,故C错误;
D.[H+]=2×10-7mol/L的溶液中,若满足[H+]=[OH-]=2×10-7mol/L,该溶液为中性,故D正确;
故选D.
点评 本题考查了溶液pH的计算,题目难度不大,明确溶液酸碱性与溶液pH的关系为解答关键,B为易错点,注意不能直接根据溶液pH大小判断溶液酸碱性,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
16.下列所述变化规律正确的是( )
| A. | Na、Mg、Al还原性依次增强 | |
| B. | S2-、Cl-、K+、Ca2+的离子半径依次减小 | |
| C. | HCl、PH3、H2S稳定性依次减弱 | |
| D. | Al(OH)3、Mg(OH)2、NaOH碱性依次减弱 |
17.25℃时,0.1mol/L下列溶液的pH如表,有关比较正确的是( )
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
| pH | 7.0 | 7.0 | 10.3 | 8.3 | 11.6 |
| A. | 酸性的相对强弱:HClO<HCO3- | |
| B. | 由水电离产生的c(H+):①=② | |
| C. | 溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-) | |
| D. | 在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L |
14.某同学根据苯和四氯化碳互溶、苯的密度比水小、四氯化碳的密度比水大的性质制作了“液体积木”.在试管中注入CCl4,再加少量水,再小心加入少量苯,溶液可出现分三层的现象,然后再用漏斗向水层中加入少量胆矾溶液及少量碘水.下列说法正确的是( )
| A. | 上中下三层的颜色分别为无色、蓝色、紫色 | |
| B. | 上中下三层的颜色分别为紫色、蓝色、紫色 | |
| C. | 振荡再静置后溶液分为两层,水在下层 | |
| D. | 振荡再静置后溶液仍分为三层 |
1.标准状况下,11.2L氧气的质量是( )
| A. | 8g | B. | 16g | C. | 32g | D. | 4g |
11.乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )


| A. | 分子式为C12H22O2 | |
| B. | 能使酸性KMnO4溶液褪色,能发生加成反应,但不能发生取代反应 | |
| C. | 1mol该有机物水解时只能消耗 1 mol NaOH | |
| D. | 1mol该有机物在一定条件下和H2反应,共消耗 H2为3mol |
18.化学中有许多的“守恒或相等”.下列说法不正确的是( )
| A. | 溶液中,稀释前溶质质量与稀释后溶质质量 | |
| B. | 溶液中,阳离子电荷总数与阴离子电荷总数 | |
| C. | 化学反应中,反应物总能量与生成物总能量 | |
| D. | 化学反应中,参加反应物总质量与生成物总质量 |
15.下列反应中,S元素的化合价升高的是( )
| A. | Zn+H2SO4═ZnSO4+H2↑ | |
| B. | C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O | |
| C. | H2S+CuSO4═CuS↓+H2SO4 | |
| D. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 |
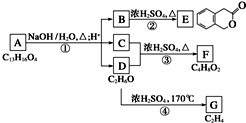 图中A、B、C、D、E、F、G均为有机化合物.根据下图回答问题.
图中A、B、C、D、E、F、G均为有机化合物.根据下图回答问题. .反应①的反应类型是水解反应(取代反应).
.反应①的反应类型是水解反应(取代反应).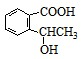 、
、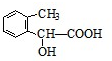 、
、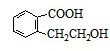 .
.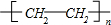 或CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH.
或CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH.