题目内容
5.能区别NaCl,MgCl2,AlCl3,FeCl3,NH4Cl溶液的一种试剂是( )| A. | H2SO4溶液 | B. | AgNO3溶液 | C. | NaOH溶液 | D. | 氨水 |
分析 五种溶液含有的阳离子各不相同,但都是氯化物,因而AgNO3溶液不能达到目的,且硫酸与五种氯化物都不反应,主要考查金属氢氧化物的溶解性及颜色.因又涉及到Al3+和Mg2+的鉴别,因此必需选强碱,以此解答该题.
解答 解:A.硫酸和五种氯化物都不反应,不能鉴别,故A错误;
B.AgNO3溶液和五种氯化物都生成沉淀,不能鉴别,故B错误;
C.加入浓NaOH溶液,NaCl无现象,MgCl2生成白色沉淀,AlCl3先生成白色沉淀,沉淀然后溶解,FeCl3生成红褐色沉淀,NH4Cl有刺激性气体生成,现象各不相同,可鉴别,故C正确;
D.加入氨水,不能鉴别氯化钠、氯化铵,也不能鉴别氯化镁和氯化铝,故D错误.
故选C.
点评 本题考查物质的检验和鉴别,侧重于元素化合物知识的综合应用,为高考常见题型,注意把握相关物质的性质,题目难度不大

练习册系列答案
相关题目
16.下列各组物质相互混合,既有气体生成又有沉淀生成的是( )
①金属钠投入到CuSO4溶液中
②过量的NaOH溶液和明矾溶液
③NaAlO2溶液和NaHCO3溶液混合
④过量的Na2O2投入FeCl2溶液
⑤金属钠投入NH4Cl溶液中.
①金属钠投入到CuSO4溶液中
②过量的NaOH溶液和明矾溶液
③NaAlO2溶液和NaHCO3溶液混合
④过量的Na2O2投入FeCl2溶液
⑤金属钠投入NH4Cl溶液中.
| A. | ①④ | B. | ②③ | C. | ②③ | D. | ①⑤ |
13.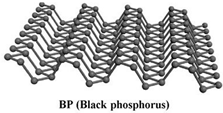 最近科学家发现黑磷 (BP,磷原子构成的二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
最近科学家发现黑磷 (BP,磷原子构成的二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
 最近科学家发现黑磷 (BP,磷原子构成的二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
最近科学家发现黑磷 (BP,磷原子构成的二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )| A. | 黑磷导电属于化学变化 | B. | 黑磷属于高分子化合物 | ||
| C. | 黑磷与白磷互为同素异形体 | D. | 黑磷高温下在空气中可以稳定存在 |
20.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置 | 溶液上层呈橙红色 | Br-还原性强于Cl- |
| D | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
10.下列分子或离子在指定的分散系中能大量共存的一组是( )
| A. | 新制氯水:Na+、K+、NO${\;}_{3}^{-}$、NH3•H2O | |
| B. | 空气:CO、CO2、SO2、CH4 | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 浓高锰酸钾溶液;H+、Na+、SO${\;}_{4}^{2-}$、Cl- |
17. 下列关于物质的分离提纯不正确的是( )
下列关于物质的分离提纯不正确的是( )
 下列关于物质的分离提纯不正确的是( )
下列关于物质的分离提纯不正确的是( )| A. | 用如图1所示装置分离CCl4和水 | |
| B. | 除去苯中的少量苯酚,加入适量浓溴水,过滤 | |
| C. | 实验室用如图2所示装置除去Cl2中的少量HCl | |
| D. | 除去O2中混有得得少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
16.制烧碱所用盐水需两次精制.第一次精制主要是用沉淀法除去粗盐水中ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
I.向粗盐水中加入过量BaCl2溶液,过滤;
II.向所得滤液中加入过量Na2C03溶液,过滤;
III.滤液用盐酸调节pH,获得一次精制盐水.
(1)过程I、II生成的部分沉淀及其溶解度(20°C/g)如下表:
①检测Fe3+是否除尽的方法是取少量过程II后的滤液于试管中,滴加几滴KSCN溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽.
②过程I选用BaCl2而不选用CaCl2,运用表中数据解释原因BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完.
③除去Mg2+的离子方程式是2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑.
④检测ca2+、Mg2+、B2+是否除尽时,只需检测Ba2+(填离子符号).
(2)第二次精制要除去微量的Iˉ、IO3ˉ、NH4+、Ca2+、Mg2+,流程示意如下: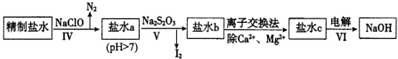
①过程IV除去的离子是NH4+、I-.
②盐水b中含有SO42-.Na2S203将IO3-还原为12的离子方程式是5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O.
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
I.向粗盐水中加入过量BaCl2溶液,过滤;
II.向所得滤液中加入过量Na2C03溶液,过滤;
III.滤液用盐酸调节pH,获得一次精制盐水.
(1)过程I、II生成的部分沉淀及其溶解度(20°C/g)如下表:
| CaS04 | Mg2(OH)2C03 | CaC03 | BaS04 | BaC03 |
| 2.6×1 0-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×1 0-3 |
②过程I选用BaCl2而不选用CaCl2,运用表中数据解释原因BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完.
③除去Mg2+的离子方程式是2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑.
④检测ca2+、Mg2+、B2+是否除尽时,只需检测Ba2+(填离子符号).
(2)第二次精制要除去微量的Iˉ、IO3ˉ、NH4+、Ca2+、Mg2+,流程示意如下:

①过程IV除去的离子是NH4+、I-.
②盐水b中含有SO42-.Na2S203将IO3-还原为12的离子方程式是5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O.
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
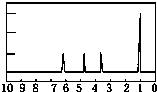 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
. +2H2O.
+2H2O.