题目内容
10.X、Y、Z三种非金属元素具有相同的电子层数,它们的气态氢化物的稳定性的强弱顺序为XH3<H2Y<HZ,下列说法中正确的是( )| A. | 原子序数:X>Y>Z | B. | 非金属性:X<Y<Z | ||
| C. | 原子半径:X<Y<Z | D. | 原子得电子能力:X>Y>Z |
分析 A、X、Y、Z 三种非金属元素具有相同的电子层数说明X、Y、Z为同一周期,同一周期元素气态氢化物的稳定性逐渐增强;
B、同一周期从左到右非金属性逐渐增强;
C、同一周期从左到右,原子半径逐渐减小;
D、非金属性越强得电子能力越强.
解答 解:A、X、Y、Z 三种非金属元素具有相同的电子层数说明X、Y、Z为同一周期,同一周期元素气态氢化物的稳定性逐渐增强,气态氢化物的稳定性的强弱顺序为:XH3<H2Y<HZ,故原子序数为X<Y<Z,故A错误;
B、同一周期从左到右非金属性逐渐增强,故非金属性为X<Y<Z,故B正确;
C、同一周期从左到右,原子半径逐渐减小,故原子半径X>Y>Z,故C错误;
D、非金属性越强得电子能力越强,所以原子得电子能力:X<Y<Z,故D错误;
故选B.
点评 本题考查了同周期元素性质的递变规律,明确氢化物越稳定,对应元素的非金属性越强为解答本题的突破口.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
10.经验规律:当成键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当差值小于1.7时,一般为共价键.下列判断正确的是( )
| A. | AlCl3为离子化合物 | B. | Mg与Cl形成共价键 | ||
| C. | SiCl4为共价化合物 | D. | K与Mg 形成共价键 |
18.某学生欲用已知物质的量浓度的醋酸来测定未知物质的量浓度的氢氧化钠溶液时,选择适当的指示剂.请填写下列空白
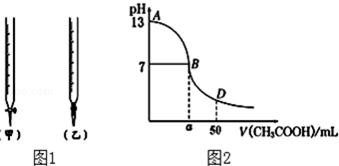
(1)用标准醋酸滴定待测的氢氧化钠溶液时(如图1),从下列选项中选出最恰当的一项 .
达到滴定终点时的现象为由红色变为无色,且半分钟内不褪色
(2)下列操作中可能使所测氢氧化钠溶液的浓度值偏低的D
A.酸式滴定管未用标准醋酸润洗就直接注入标准醋酸
B.滴定前盛放氢 氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取醋酸体积时,开始仰视读数,滴定结束后俯视读数
(3)某学生根据3次实验分别记录有关数据如表:
依据上表数据计算该氢氧化钠溶液的物质的量浓度为0.1002mol/L
(4)如2图为上述25mL NaOH溶液中逐滴滴加CH3COOH溶液过程中溶液pH的变化曲线.请回答:
B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?否(选填“是”或“否”).若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?AB区间.(若正确,此问不答).

(1)用标准醋酸滴定待测的氢氧化钠溶液时(如图1),从下列选项中选出最恰当的一项 .
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
(2)下列操作中可能使所测氢氧化钠溶液的浓度值偏低的D
A.酸式滴定管未用标准醋酸润洗就直接注入标准醋酸
B.滴定前盛放氢 氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取醋酸体积时,开始仰视读数,滴定结束后俯视读数
(3)某学生根据3次实验分别记录有关数据如表:
| 待测氢氧化钠 | 0.100mol/L醋酸的体积 | ||
| 滴定次数 | 溶液的体积(mL) | 滴定前的刻度(mL) | 滴定后的刻度(mL) |
| 第一次 | 25.00 | 1.68 | 26.89 |
| 第二次 | 25.00 | 0.00 | 27.91 |
| 第三次 | 25.00 | 0.12 | 25.01 |
(4)如2图为上述25mL NaOH溶液中逐滴滴加CH3COOH溶液过程中溶液pH的变化曲线.请回答:
B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?否(选填“是”或“否”).若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?AB区间.(若正确,此问不答).
5.下列物质性质与应用对应关系正确的是( )
| A. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 | |
| B. | 浓硫酸具有脱水性,可用于干燥氯气 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铝熔点很高,可用于制耐火材料 |
15.A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
(1)写出A、C元素的名称氮、氟
(2)B元素最高价氧化物对应水化物的化学式为H2SO4,该化合物为共价(填“共价”或“离子”)化合物.
(3)C的原子结构示意图为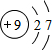 ,C的单质与H2反应的化学方程式为:H2+F2=2HF
,C的单质与H2反应的化学方程式为:H2+F2=2HF
(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有离子键、共价键.
| A | C | |
| B |
(2)B元素最高价氧化物对应水化物的化学式为H2SO4,该化合物为共价(填“共价”或“离子”)化合物.
(3)C的原子结构示意图为
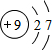 ,C的单质与H2反应的化学方程式为:H2+F2=2HF
,C的单质与H2反应的化学方程式为:H2+F2=2HF(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有离子键、共价键.
2.设NA为阿伏伽德罗常数的值,下列说法不正确的是( )
| A. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| B. | 2.8gN2和CO的混合气体中所含质子数为1.4NA | |
| C. | 235g${\;}_{92}^{235}$U发生裂变反应${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为9NA | |
| D. | 50mL12mol/L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
20.现有部分短周期元素的性质或原子结构如下表:
(1)元素X在元素周期表中的位置为第二周期第ⅣA族,它的一种核素可测定文物年代,这种核素的符号是146C.
(2)元素Y的原子结构示意图为 ,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.
,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示)
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y的原子结构示意图为
 ,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.
,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示)
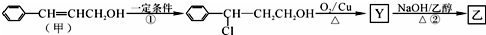
 .1mol乙最多可与5molH2反应.
.1mol乙最多可与5molH2反应.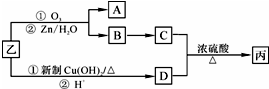
 .
. .
.