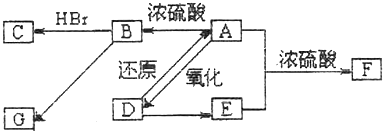
题目内容
活性氧化锌用作橡胶硫化的活性剂、补强剂.以氧化锌粗品(含铁的氧化物、CuO和SiO2等杂质)为原料制备活性氧化锌并生产其它副产品的生产工艺流程如下:
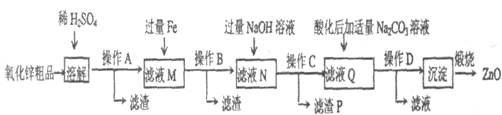
已知:Zn(OH)2可溶于NaOH溶液.
(1)操作A所用的玻璃仪器有烧杯、玻璃棒和 .
(2)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是 .
(3)加入过量铁可回收的金属是 .
(4)操作C所得的滤渣P中Fe(OH)2和Fe(OH)3的物质的量之比为5:1,该滤渣在空气中灼烧可获得高性能的磁粉Fe3O4,写出该反应的化学方程式 .
(5)“沉淀”的成分为ZnCO3?2Zn(OH)2?H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO的反应的化学方程式为 .
(6)取20.00mL滤液N,用O.02mol.L-l的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,则滤液N中Fe2+的浓度为 mol?L-l.

已知:Zn(OH)2可溶于NaOH溶液.
(1)操作A所用的玻璃仪器有烧杯、玻璃棒和
(2)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是
(3)加入过量铁可回收的金属是
(4)操作C所得的滤渣P中Fe(OH)2和Fe(OH)3的物质的量之比为5:1,该滤渣在空气中灼烧可获得高性能的磁粉Fe3O4,写出该反应的化学方程式
(5)“沉淀”的成分为ZnCO3?2Zn(OH)2?H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO的反应的化学方程式为
(6)取20.00mL滤液N,用O.02mol.L-l的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,则滤液N中Fe2+的浓度为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:制备活性氧化锌流程为:氧化锌粗品(含铁的氧化物、CuO和SiO2等杂质)中加入稀硫酸,氧化锌、铁的氧化物、氧化铜与稀硫酸反应,二氧化硅不反应,通过过滤操作分离出二氧化硅,滤液中含有铁离子、亚铁离子、锌离子、铜离子;向滤液M加入过量铁粉,铜离子被置换成铜单质,通过过滤得到的滤液N中含有亚铁离子、锌离子;
向滤液N中加入过量氢氧化钠,反应生成氢氧化铁、氢氧化亚铁沉淀,滤液Q中含有AlO2-;酸化滤液Q后加入适量碳酸钠溶液得到沉淀ZnCO3?2Zn(OH)2?H2O,经过煅烧得到ZnO,
(1)操作A为过滤,根据过滤操作方法写出还缺少的仪器名称;
(2)根据固体表面积对反应速率的影响分析;
(3)铁的还原性大于铜,铁与铜离子反应生成铜单质;
(4)根据信息判断反应物、反应条件,然后写出反应的化学方程式;
(5)根据“ZnCO3?2Zn(OH)2?H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO”可知反应物、反应条件、生成物,然后写出反应的化学方程式;
(6)根据电子守恒找出关系式,然后根据高锰酸钾的物质的量计算出亚铁离子的物质的量,再根据c=
计算出滤液N中Fe2+的浓度.
向滤液N中加入过量氢氧化钠,反应生成氢氧化铁、氢氧化亚铁沉淀,滤液Q中含有AlO2-;酸化滤液Q后加入适量碳酸钠溶液得到沉淀ZnCO3?2Zn(OH)2?H2O,经过煅烧得到ZnO,
(1)操作A为过滤,根据过滤操作方法写出还缺少的仪器名称;
(2)根据固体表面积对反应速率的影响分析;
(3)铁的还原性大于铜,铁与铜离子反应生成铜单质;
(4)根据信息判断反应物、反应条件,然后写出反应的化学方程式;
(5)根据“ZnCO3?2Zn(OH)2?H2O,“煅烧”在450~500℃下进行,煅烧获得ZnO”可知反应物、反应条件、生成物,然后写出反应的化学方程式;
(6)根据电子守恒找出关系式,然后根据高锰酸钾的物质的量计算出亚铁离子的物质的量,再根据c=
| n |
| V |
解答:
解:根据图示可知,制备流程为:氧化锌粗品(含铁的氧化物、CuO和SiO2等杂质)中加入稀硫酸,氧化锌、铁的氧化物、氧化铜与稀硫酸反应,二氧化硅不反应,通过过滤操作分离出二氧化硅,滤液中含有铁离子、亚铁离子、锌离子、铜离子;向滤液M加入过量铁粉,铜离子被置换成铜单质,通过过滤得到的滤液N中含有亚铁离子、锌离子;向滤液N中加入过量氢氧化钠,反应生成氢氧化铁、氢氧化亚铁沉淀,滤液Q中含有AlO2-;酸化滤液Q后加入适量碳酸钠溶液得到沉淀ZnCO3?2Zn(OH)2?H2O,经过煅烧得到ZnO,
(1)根据分析可知,操作A为过滤操作,过滤所用的玻璃仪器有:烧杯、玻璃棒和漏斗,还缺少漏斗,故答案为:漏斗;
(2)为了加快反应速率,增大固液接触面积,在“溶解”前将氧化锌粗品粉碎成细颗粒,故答案为:增大固液接触面积,加快溶解时的反应速率;
(3)加入过量铁粉后,铁与铜离子发生置换反应生成亚铁离子和铜单质,从而回收了铜,故答案为:Cu;
(4)滤渣P中Fe(OH)2和Fe(OH)3的物质的量之比为5:1,该滤渣在空气中灼烧可获得高性能的磁粉Fe3O4,根据质量守恒,反应产物中还会生成水,反应的化学方程式为:20Fe(OH)2+4Fe(OH)3+3O2=8Fe3O4+26H2O,
故答案为:20Fe(OH)2+4Fe(OH)3+3O2=8Fe3O4+26H2O;
(5)在450~500℃下煅烧ZnCO3?2Zn(OH)2?H2O获得ZnO,还会生成二氧化碳气体和水,反应的化学方程式为:ZnCO3?2Zn(OH)2?H2O
3ZnO+CO2↑+3H2O↑,
故答案为:ZnCO3?2Zn(OH)2?H2O
3ZnO+CO2↑+3H2O↑;
(6)取20.00mL滤液N,用O.02mol.L-l的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,高锰酸钾的物质的量为:0.02mol/L×0.018L=0.00036mol,
高锰酸根离子变成锰离子,化合价降低5价,亚铁离子变成铁离子化合价变化为1,则二者反应的关系式为:KMnO4~5Fe2+,
反应消耗的亚铁离子的物质的量为:0.00036mol×5=0.0018mol,
则滤液N中Fe2+的浓度为:c(Fe2+)=
=0.09mol/L,
故答案为:0.09.
(1)根据分析可知,操作A为过滤操作,过滤所用的玻璃仪器有:烧杯、玻璃棒和漏斗,还缺少漏斗,故答案为:漏斗;
(2)为了加快反应速率,增大固液接触面积,在“溶解”前将氧化锌粗品粉碎成细颗粒,故答案为:增大固液接触面积,加快溶解时的反应速率;
(3)加入过量铁粉后,铁与铜离子发生置换反应生成亚铁离子和铜单质,从而回收了铜,故答案为:Cu;
(4)滤渣P中Fe(OH)2和Fe(OH)3的物质的量之比为5:1,该滤渣在空气中灼烧可获得高性能的磁粉Fe3O4,根据质量守恒,反应产物中还会生成水,反应的化学方程式为:20Fe(OH)2+4Fe(OH)3+3O2=8Fe3O4+26H2O,
故答案为:20Fe(OH)2+4Fe(OH)3+3O2=8Fe3O4+26H2O;
(5)在450~500℃下煅烧ZnCO3?2Zn(OH)2?H2O获得ZnO,还会生成二氧化碳气体和水,反应的化学方程式为:ZnCO3?2Zn(OH)2?H2O
| ||
故答案为:ZnCO3?2Zn(OH)2?H2O
| ||
(6)取20.00mL滤液N,用O.02mol.L-l的KMnO4溶液进行滴定,消耗KMnO4溶液18.00mL,高锰酸钾的物质的量为:0.02mol/L×0.018L=0.00036mol,
高锰酸根离子变成锰离子,化合价降低5价,亚铁离子变成铁离子化合价变化为1,则二者反应的关系式为:KMnO4~5Fe2+,
反应消耗的亚铁离子的物质的量为:0.00036mol×5=0.0018mol,
则滤液N中Fe2+的浓度为:c(Fe2+)=
| 0.0018mol |
| 0.02L |
故答案为:0.09.
点评:本题考查了物质制备方案的设计、物质分离与提纯方法的综合应用,题目难度较大,明确制备流程为解答关键,注意掌握常见物质分离与提纯的操作方法,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验、化学计算能力.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
25℃时,在氢氧化镁悬浊液中存在沉淀溶解平衡:Mg(OH)2(s)═Mg2+(q)+2OH-(aq),已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20.下列说法错误的是( )
| A、若向Mg(OH)2浊液中加入少量NH4Cl(s),c(Mg2+)会增大 |
| B、若向Mg(OH)2浊液中滴加CuSO4溶液,沉淀将由白色逐渐变为蓝色 |
| C、若向Mg(OH)2浊液中加入适量蒸馏水,Ksp保持不变,故上述平衡不发生移动 |
| D、若向Mg(OH)2浊液中加入少量Na2CO3(s),固体质量将增大 |
实验室为标定一种烧碱样品的物质的量浓度,称取该烧碱样品4.0g配成1L溶液,取出20.00mL置于锥形瓶中,用0.1000mol?L-1 HCl标准溶液滴定,恰好完全中和时消耗标准盐酸19.00mL,若烧碱中只含有一种杂质,则不可能是( )
| A、NaHCO3 |
| B、Na2CO3 |
| C、Ca(OH)2 |
| D、NaCl |
常温下肯定是酸性溶液的是( )
| A、二氧化硫的水溶液 |
| B、氯化铵的水溶液 |
| C、pH=9的溶液 |
| D、C(H+)<C(OH-)的溶液 |
我们所吃的豆腐是一种( )
| A、氨基酸 | B、蛋白质 |
| C、脂肪 | D、淀粉 |
 A、B、C、D4种短周期元素的原子序数依次增大,其中A、C及B、D分别是同主族元素,又知两元素的质子数之和B、D是A、C的2倍,这4种元素的单质中有2种是气体,2种是固体.
A、B、C、D4种短周期元素的原子序数依次增大,其中A、C及B、D分别是同主族元素,又知两元素的质子数之和B、D是A、C的2倍,这4种元素的单质中有2种是气体,2种是固体.