题目内容
 A、B、C、D4种短周期元素的原子序数依次增大,其中A、C及B、D分别是同主族元素,又知两元素的质子数之和B、D是A、C的2倍,这4种元素的单质中有2种是气体,2种是固体.
A、B、C、D4种短周期元素的原子序数依次增大,其中A、C及B、D分别是同主族元素,又知两元素的质子数之和B、D是A、C的2倍,这4种元素的单质中有2种是气体,2种是固体.(1)写出由B、C二元素所形成的原子个数比为1:1的化合物的电子式
(2)写出2种均由A、B、C、D4种元素所组成的化合物的化学式
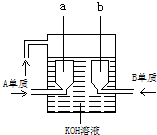
(3)用A、B两元素的单质可制成新型的化学电源,已在美国阿波罗宇宙飞船中使用,其构造如下图所示,2个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.①a是
(4)已知每生成1mol液态A2B放出286kJ的热量,又知该电池生成350gA2B可发电1kW?h,则该电池的能量转化率为
考点:位置结构性质的相互关系应用
专题:
分析:A、B、C、D都是短周期元素,它们的原子序数依次增大,A、C及B、D分别属于同主族元素,又B、D两元素原子核内质子数之和是A、C两元素原子核质子数之和的2倍,四种元素所形成的单质中有2种是气体,2种是固体,能形成气体的元素有H、N、O、F、Cl元素,
如果D是Cl元素,则B是F元素,二者的核内质子数之和为26,A和C的质子数之和为13,且A和C属于同一主族元素,则没有符合条件的元素;
如果A是H元素,C的原子序数大于B,所以C是Na元素,B、D两元素原子核内质子数之和是A、C两元素原子核质子数之和的2倍,则B是O元素、D是S元素,氢气和氧气是气体、钠和硫属于固体,所以符合条件,所以A是H元素、B是O元素、C是Na元素、D是S元素,结合物质的结构和性质解答.
如果D是Cl元素,则B是F元素,二者的核内质子数之和为26,A和C的质子数之和为13,且A和C属于同一主族元素,则没有符合条件的元素;
如果A是H元素,C的原子序数大于B,所以C是Na元素,B、D两元素原子核内质子数之和是A、C两元素原子核质子数之和的2倍,则B是O元素、D是S元素,氢气和氧气是气体、钠和硫属于固体,所以符合条件,所以A是H元素、B是O元素、C是Na元素、D是S元素,结合物质的结构和性质解答.
解答:
解:A、B、C、D都是短周期元素,它们的原子序数依次增大,A、C及B、D分别属于同主族元素,又B、D两元素原子核内质子数之和是A、C两元素原子核质子数之和的2倍,四种元素所形成的单质中有2种是气体,2种是固体,能形成气体的元素有H、N、O、F、Cl元素,
如果D是Cl元素,则B是F元素,二者的核内质子数之和为26,A和C的质子数之和为13,且A和C属于同一主族元素,则没有符合条件的元素;
如果A是H元素,C的原子序数大于B,所以C是Na元素,B、D两元素原子核内质子数之和是A、C两元素原子核质子数之和的2倍,则B是O元素、D是S元素,氢气和氧气是气体、钠和硫属于固体,所以符合条件,所以A是H元素、B是O元素、C是Na元素、D是S元素,
(1)由B、C两元素所形成的原子个数比为1:1的化合物是过氧化钠,过氧化钠的化学式为Na2O2,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ;钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,所以其晶体中存在的化学键有离子键和共价键,
;钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,所以其晶体中存在的化学键有离子键和共价键,
故答案为: ;离子键和共价键;
;离子键和共价键;
(2)由两种均由A、B、C、D四种元素所组成的化合物有硫酸氢钠和亚硫酸氢钠,硫酸氢钠和亚硫酸氢钠的化学式分别为:NaHSO4、NaHSO3,硫酸氢钠溶液呈强酸性,亚硫酸氢钠为强碱弱酸酸式盐,这两种化合物的水溶液之间发生反应的离子方程式为H++HSO3-=SO2↑+H2O,
故答案为:NaHSO4;NaHSO3;H++HSO3-=SO2↑+H2O;
(3)氢氧碱性燃料电池,负极发生氧化反应,氢气在负极放电,a为负极,电极反应式为2H2-4e-+4OH-=4H2O,正极发生还原反应,氧气在正极放电,b为正极,电极反应式O2+2H2O+4e-=4OH-.
故答案为:负,2H2-4e-+4OH-=4H2O;正,O2+2H2O+4e-=4OH-;
(4)1kW?h即3600kJ,则电池生成350gH2O可发出能量3600kJ,则生成1mol水放出的能量为
=185kJ,则电池的能量转化率为
×100%=64.7%,
故答案为:64.7%.
如果D是Cl元素,则B是F元素,二者的核内质子数之和为26,A和C的质子数之和为13,且A和C属于同一主族元素,则没有符合条件的元素;
如果A是H元素,C的原子序数大于B,所以C是Na元素,B、D两元素原子核内质子数之和是A、C两元素原子核质子数之和的2倍,则B是O元素、D是S元素,氢气和氧气是气体、钠和硫属于固体,所以符合条件,所以A是H元素、B是O元素、C是Na元素、D是S元素,
(1)由B、C两元素所形成的原子个数比为1:1的化合物是过氧化钠,过氧化钠的化学式为Na2O2,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为
 ;钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,所以其晶体中存在的化学键有离子键和共价键,
;钠离子和过氧根离子之间存在离子键,氧原子和氧原子之间存在共价键,所以其晶体中存在的化学键有离子键和共价键,故答案为:
 ;离子键和共价键;
;离子键和共价键;(2)由两种均由A、B、C、D四种元素所组成的化合物有硫酸氢钠和亚硫酸氢钠,硫酸氢钠和亚硫酸氢钠的化学式分别为:NaHSO4、NaHSO3,硫酸氢钠溶液呈强酸性,亚硫酸氢钠为强碱弱酸酸式盐,这两种化合物的水溶液之间发生反应的离子方程式为H++HSO3-=SO2↑+H2O,
故答案为:NaHSO4;NaHSO3;H++HSO3-=SO2↑+H2O;
(3)氢氧碱性燃料电池,负极发生氧化反应,氢气在负极放电,a为负极,电极反应式为2H2-4e-+4OH-=4H2O,正极发生还原反应,氧气在正极放电,b为正极,电极反应式O2+2H2O+4e-=4OH-.
故答案为:负,2H2-4e-+4OH-=4H2O;正,O2+2H2O+4e-=4OH-;
(4)1kW?h即3600kJ,则电池生成350gH2O可发出能量3600kJ,则生成1mol水放出的能量为
| 3600 | ||
|
| 185 |
| 286 |
故答案为:64.7%.
点评:本题考查了元素位置结构性质的相互关系及应用、原电池原理的应用等,熟悉短周期元素周期表及原子结构是解本题关键,根据原子结构及原子之间的关系确定元素,再根据物质的结构、性质来分析解答,注意硫酸氢钠溶液呈强酸性,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某有机物化学式C4H8O3,现有0.1mol该有机物分别与足量的钠,足量NaHCO3反应,生成标准状况下气体体积分别为2.24LH2、2.24LCO2,符合条件的该有机物结构有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
下列物质中,能用酸性高锰酸钾溶液鉴别的是( )
| A、乙烯、乙炔 |
| B、1-己烯 甲苯 |
| C、苯 正己烷 |
| D、苯 2-丁炔 |