题目内容
17.用18mol/L的浓硫酸配制100mL 2.97mol/L稀硫酸的实验步骤如下:①计算所用浓硫酸的体积②量取一定体积的浓硫酸③稀释④转移、洗涤、轻摇③定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是16.5mL,量取浓硫酸所用的量筒的规格是B(用下列编号填空)
A.10mL,B.25mL,C.50mL,D.100mL
(2)该实验除了量筒、烧杯、玻璃棒、胶头滴管外,还需要的玻璃仪器是100mL容量瓶
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线1-2cm,改用胶头滴管向容量瓶中滴加蒸馏水至凹液面最低处与刻度线相改用切为止,塞紧瓶塞,倒转摇匀并装试剂瓶.
(4)下列情况对所配制的稀硫酸浓度有何影响?
A.偏大,B.偏小,C.无影响
①定容时,俯视刻度线A;(填字母,下同)
②容量瓶用蒸馏水洗涤后残留有少量的水C;
③量筒洗涤后未干燥直接量取浓硫酸B.
分析 (1)根据溶液稀释前后溶质物质的量不变计算所需浓硫酸的体积;根据所需浓硫酸体积选择量筒规格;
(2)依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
(3)依据定容的正确操作解答;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:(1)用18mol/L的浓硫酸配制100mL 2.97mol/L稀硫酸,需选择100mL容量瓶,根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,则xmL×18mol/L=100mL×2.97mol/L,解得:x≈16.5mL,所以应量取的浓硫酸体积是16.5mL.量取浓硫酸所用的量筒的规格是25mL.
故答案为:16.5; B;
(2)用浓硫酸配制一定物质的量浓度稀硫酸,一般步骤:计算、量取、稀释、移液、洗涤、定容、摇匀等,用到的仪器:量筒、烧杯、玻璃棒、胶头滴管、100mL容量瓶,所以还需要的仪器为:100mL容量瓶;
故答案为:100mL容量瓶;
(3)定容的正确操作:继续向容量瓶中注入蒸馏水至离刻度线1-2cm,改用胶头滴管向容量瓶中滴加蒸馏水至凹液面最低处与刻度线相改用切为止;
故答案为:1-2cm;胶头滴管;
(4)①定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故选A;
②容量瓶用蒸馏水洗涤后残留有少量的水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不受影响,故选C;
③量筒洗涤后未干燥直接量取浓硫酸,导致量取的硫酸中含有的硫酸的物质的量偏小,溶液浓度偏小,故选:B.
点评 本题考查了一定物质的量浓度浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法和技巧.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | 次氯化钙溶液 | B. | 碳酸氢钙溶液 | C. | 石灰水 | D. | 硅酸钠溶液 |
| A. | 25.4% | B. | 50.8% | C. | 6mol/L | D. | 8.36mol/L |
某工厂以孔雀石[主要成分为Cu2(OH)2CO3,含有少量Fe、Si的氧化物]为主要原料制备蓝矾晶体(CuSO4·5H2O),其生产流程如图所示:
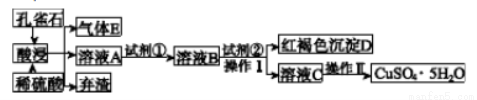
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+生成沉淀的pH分别如下表所示:
物质 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe(OH)3 | 2.2 | 3.2 |
Fe(OH)2 | 7.6 | 9.6 |
Cu(OH)2 | 4.7 | 6.4 |
回答下列问题:
(1)弃渣的主要成分是____________,Ⅱ中有“洗涤”的操作,其目的是_____________________。
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,则试剂①最好为下列中的____________,反应的离子方程式为______________________。
a.Na2O2 b.H2O2 c.Cl2 d.KSCN
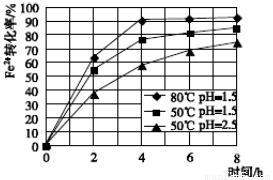
(3)根据下图有关数据,你认为工业上氧化操作时应采取措施将反应温度及溶液pH分别控制在_________________,氧化时间为________h左右。
(4)操作Ⅰ中溶液的pH应控制在________范围内。
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液进行滴定,则KMnO4溶液应置于________(填“酸”或“碱”)式滴定管中。若滴定20.00mLA的溶液,用去0.0240mol·L-1KMnO4溶液16.00mL时恰好达到滴定终点,则A溶液中Fe2+的浓度为________________。
 的量之比为_________,氮原子和氧原子的个数比为___________,该混合气体的平均摩尔质量为______________。
的量之比为_________,氮原子和氧原子的个数比为___________,该混合气体的平均摩尔质量为______________。 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.