题目内容
冬青油在医疗中常用于消炎、镇痛.
Ⅰ.冬青油的有关性质如下:
冬青油为无色透明油状液体,相对分子质量为152.密度为1.184g?cm-3,沸点223.3℃,熔点-86℃.微溶于水,易溶于有机溶剂.露置在空气中则易缓慢变色.
Ⅱ.由水杨酸和甲醇在浓硫酸存在条件下反应制得冬青油的反应如图1为:
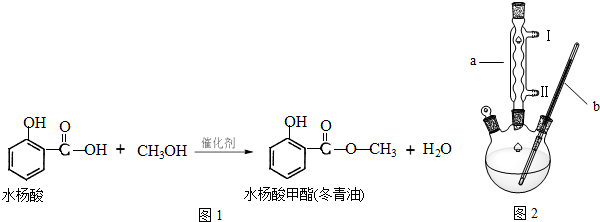
某学校的实验探究小组利用如图2装置制备冬青油.
实验操作步骤如下:
①将三颈烧瓶、量筒,置于烘箱中干燥10min;
②用天平称取6.9g水杨酸,用量筒分别量取30mL(约24g)甲醇,6mL浓硫酸,然后将3种试剂分别加入已干燥的三颈烧瓶中,组装好实验装置后置于磁力搅拌加热器上加热;
③加热到85~95℃,在甲醇回流状态下反应1.5h.反应结束后将盛有混合物的烧瓶置于冷水浴中冷却,然后再将冷却后的混合物倒入分液漏斗中,依次加入50mL5%NaHCO3溶液和30mL水,充分震荡,静置,分层;
④弃去水层,将有机层注入干燥的锥形瓶中,加入适量无水氯化钙;
⑤将步骤④所得的产品蒸馏,收集221~224℃的馏分,称得产物质量为6.8g.
试回答下列问题:
(1)本实验中浓硫酸的作用是 .
(2)装置中仪器a的名称是 ;水应该从 (填“Ⅰ”或“Ⅱ”)处流入.仪器b的适宜规格为 (填序号).
①50℃②150℃③300℃
(3)加入NaHCO3溶液的目的是 ;加入水震荡分层后,冬青油的粗产品在 (填“上”或“下”)层.
(4)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,水层应该从分液漏斗的 填“上口倒出”或“下口放出”).
(5)本次实验冬青油的产率是 .
Ⅰ.冬青油的有关性质如下:
冬青油为无色透明油状液体,相对分子质量为152.密度为1.184g?cm-3,沸点223.3℃,熔点-86℃.微溶于水,易溶于有机溶剂.露置在空气中则易缓慢变色.
Ⅱ.由水杨酸和甲醇在浓硫酸存在条件下反应制得冬青油的反应如图1为:

某学校的实验探究小组利用如图2装置制备冬青油.
实验操作步骤如下:
①将三颈烧瓶、量筒,置于烘箱中干燥10min;
②用天平称取6.9g水杨酸,用量筒分别量取30mL(约24g)甲醇,6mL浓硫酸,然后将3种试剂分别加入已干燥的三颈烧瓶中,组装好实验装置后置于磁力搅拌加热器上加热;
③加热到85~95℃,在甲醇回流状态下反应1.5h.反应结束后将盛有混合物的烧瓶置于冷水浴中冷却,然后再将冷却后的混合物倒入分液漏斗中,依次加入50mL5%NaHCO3溶液和30mL水,充分震荡,静置,分层;
④弃去水层,将有机层注入干燥的锥形瓶中,加入适量无水氯化钙;
⑤将步骤④所得的产品蒸馏,收集221~224℃的馏分,称得产物质量为6.8g.
试回答下列问题:
(1)本实验中浓硫酸的作用是
(2)装置中仪器a的名称是
①50℃②150℃③300℃
(3)加入NaHCO3溶液的目的是
(4)分液漏斗在使用前须清洗干净并
(5)本次实验冬青油的产率是
考点:制备实验方案的设计
专题:实验设计题
分析:(1)杨酸和甲醇在浓硫酸存在条件下反应制得冬青油的反应是发生的酯化反应,浓硫酸起到催化剂和吸水剂的作用;
(2)分析装置图和仪器形状分析为冷凝管,逆流冷凝效果好;反应加热加热到85~95℃,发生反应,所以反应的温度计应选择大于此量程的温度计;
(3)加入NaHCO3溶液的目的是降低酯的溶解性,水杨酸,溶解甲醇,便于分层分类得到酯;冬青油密度为1.184g?cm-3,比水溶液重;
(4)使用分液漏斗需要检查活塞处是否漏水.弃去水层,将有机层注入干燥的锥形瓶中的实验顺序可知水层从下口放出;
(5)结合反应定量关系计算理论量,产率=
×100%;
(2)分析装置图和仪器形状分析为冷凝管,逆流冷凝效果好;反应加热加热到85~95℃,发生反应,所以反应的温度计应选择大于此量程的温度计;
(3)加入NaHCO3溶液的目的是降低酯的溶解性,水杨酸,溶解甲醇,便于分层分类得到酯;冬青油密度为1.184g?cm-3,比水溶液重;
(4)使用分液漏斗需要检查活塞处是否漏水.弃去水层,将有机层注入干燥的锥形瓶中的实验顺序可知水层从下口放出;
(5)结合反应定量关系计算理论量,产率=
| 实际量 |
| 理论量 |
解答:
解:(1)杨酸和甲醇在浓硫酸存在条件下反应制得冬青油的反应是发生的酯化反应,反应是可逆反应,浓硫酸具有吸水性促进平衡正向进行,浓硫酸起到催化剂和吸水剂的作用;
故答案为:催化剂,吸水剂;
(2)分析装置图和仪器形状分析为冷凝管,逆流冷凝效果好,应从Ⅱ通入;反应加热加热到85~95℃,发生反应,所以反应的温度计应选择大于此量程的温度计,选择150C的温度计;
故答案为:冷凝管,Ⅱ;②;
(3)加入NaHCO3溶液的目的是降低酯的溶解性,水杨酸,溶解甲醇,便于分层分类得到酯;冬青油密度为1.184g?cm-3,比水溶液重,粗产品在下层;
故答案为:将冬青油中的甲醇、水杨酸溶解,便于液体分层,下层;
(4)使用分液漏斗需要检查活塞处是否漏水.弃去水层,将有机层注入干燥的锥形瓶中的实验顺序可知水层从下口放出;
故答案为:下口放出;
(5)结合反应定量关系计算理论量,

138 152
6.9g m
m=7.6g
产率=
×100%=
×100%=89.5%;
故答案为:89.5%;
故答案为:催化剂,吸水剂;
(2)分析装置图和仪器形状分析为冷凝管,逆流冷凝效果好,应从Ⅱ通入;反应加热加热到85~95℃,发生反应,所以反应的温度计应选择大于此量程的温度计,选择150C的温度计;
故答案为:冷凝管,Ⅱ;②;
(3)加入NaHCO3溶液的目的是降低酯的溶解性,水杨酸,溶解甲醇,便于分层分类得到酯;冬青油密度为1.184g?cm-3,比水溶液重,粗产品在下层;
故答案为:将冬青油中的甲醇、水杨酸溶解,便于液体分层,下层;
(4)使用分液漏斗需要检查活塞处是否漏水.弃去水层,将有机层注入干燥的锥形瓶中的实验顺序可知水层从下口放出;
故答案为:下口放出;
(5)结合反应定量关系计算理论量,

138 152
6.9g m
m=7.6g
产率=
| 实际量 |
| 理论量 |
| 6.8g |
| 7.6g |
故答案为:89.5%;
点评:本题考查了有机物的性质分析和实验制备方法,实验基本操作和有机物性质和反应原理是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A、11.2 g Fe投入到400mL 1mol/L的硝酸中充分反应,转移电子总数为0.2NA |
| B、标准状况下,11.2LC2H6含3NA个C-H极性共价键 |
| C、标准状况下,5.6LNO和5.6LO2混合后的分子总数为0.5NA |
| D、标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温下,16gO2与O3的混合气体中含氧原子数为NA |
| B、0.05mol硫酸氢钠晶体中含离子总数为0.15NA |
| C、标准状况下,22.4LCCl4中含有氯原子数目为4NA |
| D、一定条件下,2mol二氧化硫和1 mol氧气混合,反应时转移的电子数为4NA |
下列叙述中正确的是( )
| A、向某溶液中加入新制氯水和CCl4,振荡、静置,若下层显紫色,证明原溶液中存在I- |
| B、某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
| C、向某溶液中先加入新制氯水,再加入KSCN溶液,若溶液呈血红色,证明含有Fe2+ |
| D、加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- |
点燃的镁条在下列气体中完全熄灭的是( )
| A、N2 |
| B、CO2 |
| C、Ar |
| D、Cl2 |
下列叙述不正确的是( )
| A、根据金属活动性顺序表,可以推断冶炼金属时可能的方法 |
| B、CaCl2、MgCl2晶体都容易潮解,它们潮解的实质是晶体表面吸水形成溶液 |
| C、根据某元素原子的质子数和中子数,可以确定该元素的相对原子质量 |
| D、根据酸、碱、盐的溶解性表,可以判断某些溶液中的复分解反应能否进行 |


