题目内容
用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A、11.2 g Fe投入到400mL 1mol/L的硝酸中充分反应,转移电子总数为0.2NA |
| B、标准状况下,11.2LC2H6含3NA个C-H极性共价键 |
| C、标准状况下,5.6LNO和5.6LO2混合后的分子总数为0.5NA |
| D、标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.发生反应为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,铁的物质的量为0.2mol,硝酸的物质的量为0.4mol,依据方程式可知铁过量,转移电子数依据硝酸的量计算;
B.依据n=
计算物质的量,结合乙烷分子结构计算含有的C-H极性共价键;
C.在NO2气体中存在平衡:2NO2?N2O4,导致气体体积偏小;
D.根据氢气的物质的量计算转移的电子数.
B.依据n=
| V |
| Vm |
C.在NO2气体中存在平衡:2NO2?N2O4,导致气体体积偏小;
D.根据氢气的物质的量计算转移的电子数.
解答:
解:A.发生反应为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,铁的物质的量为0.2mol,硝酸的物质的量为0.4mol,依据方程式可知铁过量,转移电子数依据硝酸的量计算,依据方程式可知消耗8mol硝酸生成2mol一氧化氮转移6mol电子,所以消耗0.4mol硝酸转移0.3mol电子,个数为0.3NA,故A错误;
B.标准状况下,11.2LC2H6的物质的量=
=0.5mol,结合乙烷分子结构计算含有的C-H极性共价键=0.5mol×6×NA=3NA,故B正确;
C.一氧化氮和氧气不需要任何条件即可反应,由2NO+O2═2NO2,分子数减少,即分子总数小于0.5NA,故C错误;
D.铝与氢氧化钠溶液反应中氢元素化合价由+1价降低为0价,反应生成1mol氢气时,转移的电子数为1mol×2×NAmol-1=2NA,故D错误;
故选B.
B.标准状况下,11.2LC2H6的物质的量=
| 11.2L |
| 22.4L/mol |
C.一氧化氮和氧气不需要任何条件即可反应,由2NO+O2═2NO2,分子数减少,即分子总数小于0.5NA,故C错误;
D.铝与氢氧化钠溶液反应中氢元素化合价由+1价降低为0价,反应生成1mol氢气时,转移的电子数为1mol×2×NAmol-1=2NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意乙烷分子的结构,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
某温度下,向2L恒容密闭容器中充入1.0mol A和1.0mol B,反应A(g)+B(g)?C(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A、反应在前5 s的平均速率v(A)=0.17 mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时c(A)=0.41 mol?L-1,则反应的△H>0 |
| C、相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大于80% |
| D、相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆) |
下列对合成材料的认识不正确的是( )
| A、苯酚和甲醛在一定条件下可合成酚醛树脂 |
B、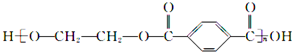 的单体是HOCH2CH2OH与 的单体是HOCH2CH2OH与 |
| C、聚苯乙烯是由苯乙烯加聚生成的纯净物 |
D、 的单体有3种 的单体有3种 |
不能用于实验室中制取NH3的是( )
| A、加热分解氯化铵固体 |
| B、熟石灰和氯化铵固本混合加热 |
| C、在浓氨水中加固体氢氧化钠 |
| D、在浓氨水中加生石灰 |
用惰性电极分别电解下列各电解质的水溶液,一段时间后(设电解质足量),向电解后溶液中加入适量原电解质,可以使溶液恢复到电解前的浓度的是( )
| A、Cu(NO3)2 |
| B、K2SO4 |
| C、HCl |
| D、NaOH |

 污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等.
污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等.