题目内容
尿素(CO(NH2)2,其中氮元素为-3价)在工业中有着非常重要的地位.
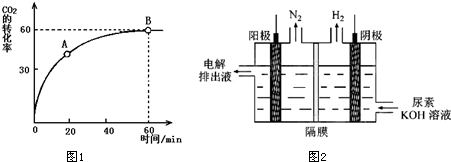
(1)工业上在183℃、14MPa条件下,当17g液氨与足量CO2完全反应生成CO(NH2)2(l)和H2O(l)时,放出51.9kJ/mol的热量,写出反应的热化学方程式 ,
按n(NH3):n(CO2)=4:1充入时,CO2的转化率随时间的变化关系如图1所示.
①A点的逆反应速率v速(CO2) B点的正反应速率为v正(CO2)(填“大于”、“小于”或“等于”)
②NH3的平衡转化率为 .
(2)H2是未来重要的能源它的制取与储存是必须解决的两大问题.电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为 .Mg2Cu是一种储氢合金.350℃时,Mg2Cu与H2反应生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为7.7%),写出反应的化学方程式 .
(3)在工业上常用尿素还原法制溴化钾:50~60℃的碳酸钾溶液中加入尿素,溶解后再加入液溴,生成溴化钾和对环境无污染的常见气体,请写出发生反应的化学方程式 .

(1)工业上在183℃、14MPa条件下,当17g液氨与足量CO2完全反应生成CO(NH2)2(l)和H2O(l)时,放出51.9kJ/mol的热量,写出反应的热化学方程式
按n(NH3):n(CO2)=4:1充入时,CO2的转化率随时间的变化关系如图1所示.
①A点的逆反应速率v速(CO2)
②NH3的平衡转化率为
(2)H2是未来重要的能源它的制取与储存是必须解决的两大问题.电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为
(3)在工业上常用尿素还原法制溴化钾:50~60℃的碳酸钾溶液中加入尿素,溶解后再加入液溴,生成溴化钾和对环境无污染的常见气体,请写出发生反应的化学方程式
考点:化学平衡的计算,热化学方程式,原电池和电解池的工作原理,转化率随温度、压强的变化曲线
专题:基本概念与基本理论
分析:(1)17g液氨的物质的量是1mol,1mol液氨完全反应放出51.9kJ热量,则2mol液氨完全反应放出103.8kJ 热量,据此书写热化学反应方程式;
①物质的浓度的越大其反应速率越大;
②根据二氧化碳的量计算参加反应的氨气的量,再结合转化率公式计算;
(2)阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水;
令金属氢化物为RHx,金属R的相对分子质量为a,则
=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2;
(3)根据元素守恒结合物质性质知,生成的气体应该是二氧化碳、氮气,同时还生成水,根据反应物、生成物及反应条件书写方程式.
①物质的浓度的越大其反应速率越大;
②根据二氧化碳的量计算参加反应的氨气的量,再结合转化率公式计算;
(2)阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水;
令金属氢化物为RHx,金属R的相对分子质量为a,则
| x |
| a+x |
(3)根据元素守恒结合物质性质知,生成的气体应该是二氧化碳、氮气,同时还生成水,根据反应物、生成物及反应条件书写方程式.
解答:
解:(1)17g液氨的物质的量是1mol,1mol液氨完全反应放出51.9kJ热量,则2mol液氨完全反应放出103.8kJ 热量,所以其热化学反应方程式为2NH3(l)+CO2(g)
CO(NH2)2(l)+H2O(l)△H=-103.8kJ/mol,故答案为:2NH3(l)+CO2(g)
CO(NH2)2(l)+H2O(l)△H=-103.8kJ/mol;
①物质浓度越大,反应速率越大,A点生成物浓度小于B点生成物浓度,所以A点逆反应速率小于B点逆反应速率,B点正逆反应速率相等,所以A点逆反应速率小于B点正反应速率,故答案为:小于;
②假设充入氨气、二氧化碳的物质的量分别是4mol、1mol,达到平衡时,反应的n(CO2)=1mol×0.6=0.6mol,则反应的n(NH3)=2n(CO2)=1.2mol,氨气的转化率=
×100%=30%,故答案为:30%;
(2)阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
令金属氢化物为RHx,金属R的相对分子质量为a,则
=0.077,即923x=77a,X为金属的化合价,讨论可得x=2,a=24,故该金属氢化物为MgH2,该反应方程式为2Mg2Cu+3H2
MgCu2+3MgH2,
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;2Mg2Cu+3H2
MgCu2+3MgH2;
(3)无毒的含碳、N元素的物质分别为二氧化碳、氮气,根据元素守恒知,还生成水,所以反应方程式为3K2CO3+CO(NH2)2+3Br2
6KBr+4CO2↑+N2↑+2H2O,故答案为:3K2CO3+CO(NH2)2+3Br2
6KBr+4CO2↑+N2↑+2H2O.
| ||
| 14MPa |
| ||
| 14MPa |
①物质浓度越大,反应速率越大,A点生成物浓度小于B点生成物浓度,所以A点逆反应速率小于B点逆反应速率,B点正逆反应速率相等,所以A点逆反应速率小于B点正反应速率,故答案为:小于;
②假设充入氨气、二氧化碳的物质的量分别是4mol、1mol,达到平衡时,反应的n(CO2)=1mol×0.6=0.6mol,则反应的n(NH3)=2n(CO2)=1.2mol,氨气的转化率=
| 1.2mol |
| 4mol |
(2)阳极上尿素失电子和氢氧根离子反应生成碳酸根离子、氮气和水,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;
令金属氢化物为RHx,金属R的相对分子质量为a,则
| x |
| a+x |
| ||
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O;2Mg2Cu+3H2
| ||
(3)无毒的含碳、N元素的物质分别为二氧化碳、氮气,根据元素守恒知,还生成水,所以反应方程式为3K2CO3+CO(NH2)2+3Br2
| ||
| ||
点评:本题考查较综合,涉及电解原理、氧化还原反应、化学平衡的计算等知识点,根据物质的性质、反应方程式进行分析解答,注意(2)中氢化物的确定,为难点.

练习册系列答案
相关题目
下列五种烃①异戊烷②新戊烷③戊烷④丙烷⑤丁烷,按沸点由高到低的顺序排列的是( )
| A、①>②>③>④>⑤ |
| B、②>③>⑤>④>① |
| C、③>①>②>⑤>④ |
| D、④>⑤>②>①>③ |
将Li3N固体溶于水中,产生了大量的氨气,下列有关此过程中的说法,正确的是( )
| A、产生氨气过程无能量变化 |
| B、Li3N中只含有离子键 |
| C、Li3N中含有离子键、共价键 |
| D、产生氨气过程有电子转移 |

 为验证干燥的Cl2没有漂白性,而Cl2与水反应后的产物具有漂白性,肖飞同学设计了如下实验.(其中a是有色布条)
为验证干燥的Cl2没有漂白性,而Cl2与水反应后的产物具有漂白性,肖飞同学设计了如下实验.(其中a是有色布条)