题目内容
 为验证干燥的Cl2没有漂白性,而Cl2与水反应后的产物具有漂白性,肖飞同学设计了如下实验.(其中a是有色布条)
为验证干燥的Cl2没有漂白性,而Cl2与水反应后的产物具有漂白性,肖飞同学设计了如下实验.(其中a是有色布条)(1)A中浓硫酸的作用是
(2)实验中观察到的现象是
(3)D装置的作用是
考点:氯气的化学性质
专题:卤族元素
分析:(1)依据实验的目的和浓硫酸的性质解答;
(2)依据干燥的氯气没有漂白性,氯气与水反应生成的次氯酸具有漂白性解答;
(3)氯气有毒,不能直接排放的空气中,可以用氢氧化钠吸收氯气,氢氧化钠与氯气反应生成氯化钠和次氯酸钠和水.
(2)依据干燥的氯气没有漂白性,氯气与水反应生成的次氯酸具有漂白性解答;
(3)氯气有毒,不能直接排放的空气中,可以用氢氧化钠吸收氯气,氢氧化钠与氯气反应生成氯化钠和次氯酸钠和水.
解答:
解:(1)要验证干燥的Cl2没有漂白性,而Cl2与水反应后的产物具有漂白性,则通入B的氯气应为干燥的氯气,所以A装置盛有浓硫酸是用来干燥氯气的,
故答案为:干燥氯气;
(2)干燥的氯气没有漂白性,氯气与水反应生成的次氯酸具有漂白性,所以B中的有色布条不褪色,C中的有色布条褪色;
故答案为:B中的有色布条不褪色,C中的有色布条褪色;干燥的氯气没有漂白性,而氯气与水反应后的产物具有漂白性;
(3)氯气有毒,不能直接排放的空气中,可以用氢氧化钠吸收氯气,反应的化学方程式为:Cl2+2NaOH═NaCl+NaClO+H2O;
故答案为:吸收尾气; Cl2+2NaOH═NaCl+NaClO+H2O.
故答案为:干燥氯气;
(2)干燥的氯气没有漂白性,氯气与水反应生成的次氯酸具有漂白性,所以B中的有色布条不褪色,C中的有色布条褪色;
故答案为:B中的有色布条不褪色,C中的有色布条褪色;干燥的氯气没有漂白性,而氯气与水反应后的产物具有漂白性;
(3)氯气有毒,不能直接排放的空气中,可以用氢氧化钠吸收氯气,反应的化学方程式为:Cl2+2NaOH═NaCl+NaClO+H2O;
故答案为:吸收尾气; Cl2+2NaOH═NaCl+NaClO+H2O.
点评:本题考查了氯气性质的检验,题目难度不大,明确氯气和次氯酸的性质是解题关键.

练习册系列答案
相关题目
根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
| A、锂(Li)的原子失电子能力比钠弱 |
| B、砹(At)的氢化物不稳定 |
| C、H2S比水稳定 |
| D、氢氧化钠比氢氧化镁的碱性强 |
 设计出燃料电池使汽油(设其成分为C5H12)氧化直接产生电流,是21世纪最富有挑战性的课题之一.最近有人设计了一种固体燃料电池,以掺杂了氧化钇的固体氧化锆为电解质.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列关于该电池的判断中,错误的是( )
设计出燃料电池使汽油(设其成分为C5H12)氧化直接产生电流,是21世纪最富有挑战性的课题之一.最近有人设计了一种固体燃料电池,以掺杂了氧化钇的固体氧化锆为电解质.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列关于该电池的判断中,错误的是( )| A、该电池的正极反应式为:O2+2H2O+4e-=4OH- |
| B、氧化钇和氧化锆的化学式分别为Y2O3和ZrO2,掺杂氧化钇的氧化锆晶体中存在晶体缺陷,其导电性比纯氧化锆晶体强得多 |
| C、该燃料电池外部的电流方向为正极一负极,内部阴离子向负极移动 |
| D、燃料电池相对于汽油直接燃烧,具有较高的能量利用率 |
 完成以下三个小题
完成以下三个小题


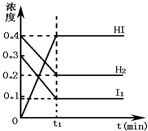 可逆反应H2(g)+I2(g)?2HI(g)在一定的条件下反应混合物中各组分的浓度(mol?L-1)与时间t(min)的变化曲线如图所示,根据图示,回答:
可逆反应H2(g)+I2(g)?2HI(g)在一定的条件下反应混合物中各组分的浓度(mol?L-1)与时间t(min)的变化曲线如图所示,根据图示,回答: