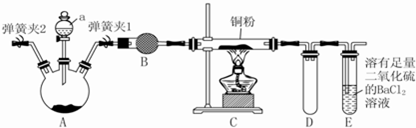
题目内容
14.为了测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓硝酸中,待合金完全溶解后,收集到6.72L(标准状况)NO和NO2的混合气体,并测得溶液中H+浓度为1mol/L.假设反应后溶液的体积仍为80mL,试计算.(1)被还原硝酸的物质的量.
(2)合金中银的质量分数.
分析 (1)被还原的硝酸生成NO2或NO2、NO混合物,根据N元素守恒计算被还原硝酸的物质的量;
(2)设混合物中Cu、Ag物质的量分别为xmol、ymol,产物Cu(NO3)2、AgNO3中含NO3-物质的量各为2xmol、ymol,根据合金质量及N原子守恒列方程,再根据m=nM计算Ag的质量,进而计算合金中银的质量分数.
解答 解:(1)被还原的硝酸生成NO2或NO2、NO混合物,根据N元素守恒,被还原的硝酸的物质的量为:n(HNO3)=n(气体)=6.72 L÷22.4L/mol=0.3mol,
答:被还原的硝酸的物质的量为0.3mol;
(2)反应的n(HNO3)=13.5 mol/L×0.08L-1 mol/L×0.08L=1 mol
设合金中铜、银物质的量分别为xmol、ymol,则:64x+108y=30
产物Cu(NO3)2、AgNO3中含NO3-物质的量各为2x mol、y mol,据N守恒可得:2x+y+0.3=1,
联立方程,解得:x=0.3、y=0.1,
故合金中银的质量为:0.1 mol×108g/mol=10.8g,
合金中Ag的质量分数为:$\frac{10.8g}{30g}$×100%=36.0%,
答:合金中银的质量质量分数为36.0%.
点评 本题考查混合物反应的计算、氧化还原反应计算,题目难度中等,明确反应中硝酸起氧化剂、还原剂作用为解答关键,注意掌握质量守恒在化学计算中的应用方法.

练习册系列答案
相关题目
5.生活中很多现象都涉及能量的转化.下列反应中属于吸热反应是( )
| A. | 煅烧石灰石 | B. | 炸药爆炸 | ||
| C. | 食物因氧化而腐败 | D. | 石灰水中和酸性土壤 |
2.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S ②离子半径:F->Na+>Mg2+>Al3+
③酸性:H3PO4>H2SO4>HClO4④结合质子能力:OH->CH3COO->Cl-( )
①热稳定性:H2O>HF>H2S ②离子半径:F->Na+>Mg2+>Al3+
③酸性:H3PO4>H2SO4>HClO4④结合质子能力:OH->CH3COO->Cl-( )
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
9.用下列方法:①KMnO4受热分解;②KClO3受热分解(用MnO2作催化剂);
③2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ ④2Na2O2+2H2O═4NaOH+O2↑,若要制得相同质量的氧气,上述四种方法中所转移的电子数目之比是( )
③2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ ④2Na2O2+2H2O═4NaOH+O2↑,若要制得相同质量的氧气,上述四种方法中所转移的电子数目之比是( )
| A. | 3:2:1:4 | B. | 1:1:1:1 | C. | 1:2:1:2 | D. | 2:2:1:1 |
6.科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )
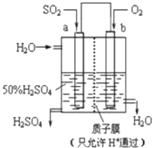

| A. | a为正极,b为负极 | |
| B. | 生产过程中H+向a电极区域运动 | |
| C. | 电子从b极向a极移动 | |
| D. | 负极反应式为:2H2+SO2-2e-=SO42-+4H+ |
4.根据元素周期律及物质结构的有关知识,以下有关排序正确的是( )
| A. | 稳定性:HCl>H2S>H2O | B. | 酸性:HClO4>HNO3>H3PO4 | ||
| C. | 还原性:HCl>HBr>HI | D. | 碱性:NaOH>Mg(OH)2>Ba(OH)2 |
 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X是
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X是