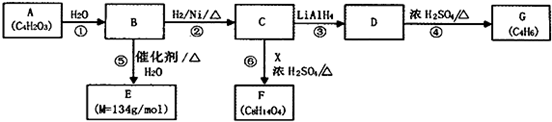
题目内容
3.为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先取一定量乙醇与浓硫酸反应,将生成的气体通入溴水中,发现溶液褪色,即认为证明乙烯与溴水发生了加成反应.乙同学发现在甲同学的实验中,制备的乙烯有刺激性气味,推测在制得的乙烯中还可能含有少量的杂质气体,由此他提出必须先除去杂质,再与溴水反应.请你回答下列问题:(1)写出甲同学实验中制备乙烯的反应方程式CH3CH2OH$→_{△}^{浓硫酸}$CH2=CH2↑+H2O;
(2)甲同学设计的实验不能(填能或不能)验证乙烯一定与溴水发生了加成反应,其理由是使溴水褪色的反应,未必是加成反应,使溴水褪色的物质,未必是乙炔.
(3)乙同学推测此乙烯中必定含有的杂质气体与溴水反应的化学方程式是Br2+H2S═S↓+2HBr;
(4)请你选用下列装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品.
可供选用的装置:

可供选用的试剂:NaOH溶液、酸性高锰酸钾溶液、溴水、品红溶液、水.
分析 (1)酒精在浓硫酸作用下发生消去反应生成乙烯;
(2)生成的乙炔中混有硫化氢气体,可与溴水发生氧化还原反应而使溴水褪色;
(3)电石中含有硫化物,与水反应生成硫化氢气体;
(4)实现乙同学的方案应用硫酸铜溶液除去硫化氢并检验是否完全除尽,之后再用溴水检验是否生成乙炔.
解答 解:(1)酒精在浓硫酸作用下发生消去反应生成乙烯,反应的化学方程式为:CH3CH2OH$→_{△}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{△}^{浓硫酸}$CH2=CH2↑+H2O;
(2)生成的乙炔中混有硫化氢气体,可与溴水发生氧化还原反应而使溴水褪色,使溴水褪色的反应,未必是加成反应,使溴水褪色的物质,未必是乙炔,
故答案为:不能;使溴水褪色的反应,未必是加成反应,使溴水褪色的物质,未必是乙炔;
(3)电石中含有硫化物,与水反应生成硫化氢气体,硫化氢气体具有还原性,能与溴水发生氧化还原反应生成硫和溴化氢,反应方程式为Br2+H2S═S↓+2HBr,
故答案为:Br2+H2S═S↓+2HBr;
(4)实现乙同学的方案应用硫酸铜溶液除去硫化氢并检验是否完全除尽,之后再用溴水检验是否生成乙炔,装置内所放的化学药品及装置为 ,
,
故答案为: .
.
点评 本题考查乙炔的制备和性质实验,题目难度不大,本题中注意乙炔的除杂和性质实验,注意与溴水反应的性质.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.某同学在做同周期元素性质递变规律试验时,自己设计了一套试验方案,经老师批准后,进行试验.试验现象记录如表.(实验方案和有关的试验现象不一定对应)
请根据记录回答下列问题:
(1)该同学的试验目的为:第三周期元素性质递变规律.
(2)请根据实验记录表,填写试验现象序号对应的试验方案编号:
Ⅰ3,Ⅱ1,Ⅲ5,Ⅳ4.
(3)请分别写出下列实验方案中,各现象对应的离子方程式:
试验方案2:Cl2+H2S=S↓+2H++2Cl-;
试验方案6:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O或(Al3++4OH-=AlO2-+2H2O).
(4)试验结论是:第三周期元素随原子序数的增大,元素的金属性逐渐减弱,非金属性逐渐增强.
| 实验方案 | 试验现象 |
| 1 用砂纸打磨后的镁条与沸水反应,再向反应溶液中滴加酚酞 2 向Na2S 饱和溶液中滴加新制的氯水 3 钠与滴有酚酞的冷水反应 4 镁条与amol/L的盐酸反应 5 铝片与amol/L的盐酸反应 6 向AlCl3溶液中滴加NaOH,至过量 | Ⅰ浮于水面,熔成小球,四处游动,逐渐缩小,溶液变红 Ⅱ放出无色气体,气体可燃,溶液变浅红色Ⅲ反应不是很剧烈,产生的气体可燃 Ⅳ剧烈反应,产生的气体可燃 Ⅴ先生成白色絮状沉淀,继而沉淀消失 Ⅵ生成淡黄色沉淀 |
(1)该同学的试验目的为:第三周期元素性质递变规律.
(2)请根据实验记录表,填写试验现象序号对应的试验方案编号:
Ⅰ3,Ⅱ1,Ⅲ5,Ⅳ4.
(3)请分别写出下列实验方案中,各现象对应的离子方程式:
试验方案2:Cl2+H2S=S↓+2H++2Cl-;
试验方案6:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O或(Al3++4OH-=AlO2-+2H2O).
(4)试验结论是:第三周期元素随原子序数的增大,元素的金属性逐渐减弱,非金属性逐渐增强.
14.现有下列五个转化:①SiO2→Na2SiO3 ②CuSO4→CuCl2 ③SiO2→H2SiO3 ④CuO→Cu(OH)2 ⑤Na2O2→NaOH,其中不能通过一步反应实现的是( )
| A. | ①② | B. | ③④ | C. | ②③④ | D. | ②③④⑤ |
11.下列叙述错误的是( )
| A. | 用新制的银氨溶液可区分甲酸甲酯和乙醛 | |
| B. | 用溴水一种试剂可鉴别甲苯、乙烯、乙醇、四氯化碳四种液体 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用金属钠可区分乙醇和乙醚 |
18.下列各组中,互称为同素异形体的是( )
| A. | 12C和14C | B. | 水和冰 | C. | O2和O3 | D. | CO和CO2 |
12.今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-,现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.792L(已换算成标准状况,且设气体全部逸出);②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.根据上述实验,以下推测正确的是( )
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32- 一定存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
13.已知分解1mol KClO3放出热量38.8kJ,在MnO2下加热,KClO3的分解机理为:
①2KClO3+4MnO2═2KCl+2Mn2O7 慢
②2Mn2O7═4MnO2+3O2 快
下列有关说法不正确的是( )
①2KClO3+4MnO2═2KCl+2Mn2O7 慢
②2Mn2O7═4MnO2+3O2 快
下列有关说法不正确的是( )
| A. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 | |
| B. | 1 g KClO3,1 g MnO2,0.1 g Mn2O7混合加热,充分反应后MnO2质量为1 g | |
| C. | KClO3分解速率快慢主要取决于反应② | |
| D. | 1 mol KClO3所具有的总能量高于1 mol KCl所具有的总能量 |

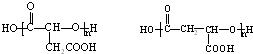 .
.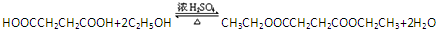 .
. .
.