题目内容
7.陶弘景对硝酸钾有如下记载:“先时有人得一种物,其色理与朴硝(硫酸钠)大同小异,胐如握雪不冰.强烧之,紫青烟起,仍成灰,不停沸,如朴硝,云是真消石(硝酸钾)也.”下列有关说法错误的是( )| A. | 朴硝和消石加强热都不分解 | |
| B. | 朴硝和消石都属于强电解质 | |
| C. | 朴硝和消石都既含有离子键又含有共价键 | |
| D. | “紫青烟起”是由于消石中的K+在火焰上灼烧时呈现出特殊颜色 |
分析 A.硝酸钾强热分解生成亚硝酸钾和氧气;
B.朴硝和消石都属于强酸强碱盐;
C.含氧酸根离子内有共价键;
D.K元素的焰色反应为紫色.
解答 解:A.硫酸钠不易分解,硝酸钾强热分解生成亚硝酸钾和氧气,故A错误;
B.朴硝和消石都属于强酸强碱盐,属于强电解质,故B正确;
C.含氧酸根离子硝酸根离子和硫酸根离子内有共价键,故C正确;
D.K元素的焰色反应为紫色,故“紫青烟起”是由于消石中的K+在火焰上灼烧时呈现出特殊颜色,故D正确,
故选A.
点评 本题考查了电解质与非电解质的概念性问题以及化学键的知识,难道不大,注意知识的迁移即可.

练习册系列答案
相关题目
18. 某化学兴趣小组使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
某化学兴趣小组使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
一.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
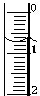
(3)读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.如果液面位置如图所示,则此时的读数为0.70mL.
(4)滴定.当溶液由无色恰好变为红色,且半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
二.实验记录:
Ⅲ.数据处理与讨论:
(5)市售白醋总酸量=4.500g/100mL.
 某化学兴趣小组使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
某化学兴趣小组使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).一.实验步骤:
(1)配制100mL待测白醋溶液.量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶(填仪器名称)中定容,摇匀即得.
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管(填仪器名称)的初始读数.如果液面位置如图所示,则此时的读数为0.70mL.
(4)滴定.当溶液由无色恰好变为红色,且半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
二.实验记录:
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(5)市售白醋总酸量=4.500g/100mL.
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1NaNO3溶液:H+、Fe2+、Cl-、SO42-、K+ | |
| B. | $\frac{{K}_{W}}{c({H}^{+})}$=10-13mol•L-1的溶液:Na+、AlO2-、OH-、NO3- | |
| C. | 0.1 mol•L-1NH3•H2O溶液:K+、Na+、NO3-、C1- | |
| D. | 加入铝粉能产生大量H2的溶液:Na+、K+、Cl-、HCO3- |
16.用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,2.24 L CHCl3的原子总数为0.1 NA | |
| B. | 1mol-OH所含的电子数为10NA | |
| C. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NA | |
| D. | 常温常压下,1mol丙烷所含有的共价键数目为12NA |
13.如图装置所示的实验中,能达到实验目的是( )
| A. | 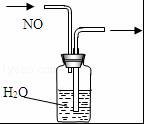 排水集气法收集NO | B. | 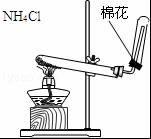 实验室制取氨气 | ||
| C. | 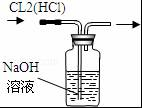 除去氯气中的氯化氢 | D. | 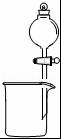 分离碘酒中的碘和酒精 |
14.继屠呦呦从青蒿中成功提取出青蒿素后,中国科学院上海有机化学研究所又在1982年人工合成了青蒿素,其部分合成路线如图所示:下列说法不正确的是( )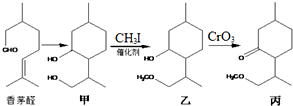

| A. | 香茅醛能发生加聚反应和缩聚反应 | |
| B. | “甲→乙”发生了取代反应 | |
| C. | 甲中不同化学环境的羟基化学性质不同 | |
| D. | 香茅醛存在顺反异构现象 |
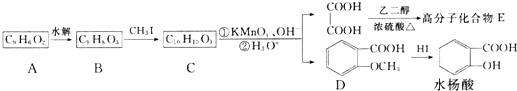
 .
. .
. A、B、C、D、E、F为前四周期元素,它们的原子序数依次增大.A、C的基态原子的电子排布中L能层都有两个未成对电子,C、D同主族,E的基态原子的电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.
A、B、C、D、E、F为前四周期元素,它们的原子序数依次增大.A、C的基态原子的电子排布中L能层都有两个未成对电子,C、D同主族,E的基态原子的电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满. .
. .DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.
.DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.