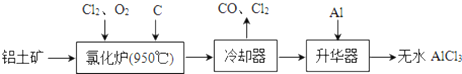
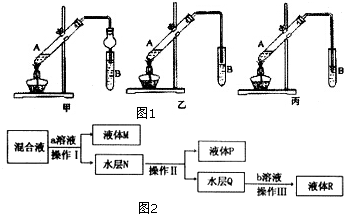
题目内容
2.室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,c(H+)减小 | |
| C. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| D. | 溶液中由水电离出的c(H+)=1×10-3 mol•L-1 |
分析 A.加水稀释促进醋酸电离,但氢离子和醋酸根离子浓度减小;
B.加水稀释促进醋酸电离,但氢离子浓度减小;
C.pH=3的醋酸浓度大于0.001mol/L,pH=11 NaOH溶液浓度为0.001mol/L;
D.醋酸中氢氧根离子是水电离的,根据水的离子积可计算出水电离的氢离子浓度.
解答 解:A.加水稀释促进醋酸电离,但氢离子和醋酸根离子浓度减小,溶液导电能力与离子浓度成正比,所以溶液导电性减弱,故A错误;
B.加水稀释促进醋酸电离,溶液中氢离子个数增大程度小于溶液体积增大程度,所以氢离子浓度减小,故B正确;
C.pH=3的醋酸浓度大于0.001mol/L,pH=11 NaOH溶液浓度为0.001mol/L,两种溶液等体积混合,醋酸有剩余,溶液呈酸性,故C错误;
D.pH=3的醋酸溶液中,氢离子抑制了水的电离,醋酸溶液中的氢氧根离子是水电离的,则该醋酸溶液中由水电离出的c(H+)=$\frac{1×1{0}^{-14}}{1×1{0}^{-3}}$mol/L=1×10-11mol•L-1,故D错误;
故选B.
点评 本题考查了弱电解质的电离,题目难度中等,明确弱电解质电离特点是解本题关键,加水稀释促进醋酸电离,但氢离子浓度降低,很多同学往往认为“促进电离,氢离子浓度增大”而导致错误,为易错点,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
13.下列离子方程式正确的是( )
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铝溶液中加入过量氨水制取氢氧化铝 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 氢氧化钠溶液中通入少量二氧化硫气体 SO2+OH-═HSO3- |
10.有关硅及其化合物的叙述正确的是( )
| A. | 二氧化硅与任何酸都不反应 | |
| B. | 二氧化碳通入水玻璃中能得到硅酸沉淀 | |
| C. | 硅的性质很稳定,能以单质形式存在于地壳中 | |
| D. | 二氧化硅溶于水显酸性 |
17.下列物质能跟镁粉反应,并有氢气放出的是( )
①醋酸溶液 ②福尔马林
③葡萄糖粉末共热 ④乙醚.
①醋酸溶液 ②福尔马林
③葡萄糖粉末共热 ④乙醚.
| A. | ①、② | B. | ①、④ | C. | ①、③ | D. | ②、④ |
11.化学是一门实用性强的自然科学,在社会、生产、生活中起着重要的作用,下列说法不正确的是( )
| A. | 油条的制作口诀是“一碱、二矾、三钱盐”,其中的“碱”是烧碱 | |
| B. | 黑火药的最优化配方是“一硫二硝三木炭”,其中的“硝”是硝酸钾 | |
| C. | 过滤操作要领是“一贴二低三靠”,其中“贴”是指滤纸紧贴漏斗的内壁 | |
| D. | “固体需匙或纸槽,一送二竖三弹弹;块固还是镊子好,一横二放三慢竖“.前一个固体一般指粉末状固体 |